题目内容
(2009?南京二模)开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是
a.电解水制氢:2H2O
2H2↑+O2↑
b.高温使水分解制氢:2H2O
2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
d.天然气制氢:CH4+H2O
CO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4
MnFe2O4-X+
O2,则第二步反应的化学方程式为
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
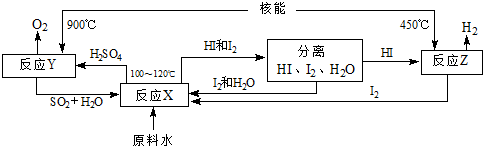
反应X的化学方程式为
(1)下列做法有助于能源“开源节流”的是
bcd
bcd
(填字母).a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是
C
C
(填字母).a.电解水制氢:2H2O
| ||
b.高温使水分解制氢:2H2O
| ||
c.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
d.天然气制氢:CH4+H2O
| 高温 |
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4
| ||
| X |
| 2 |
MnFe2O4-X+xH20=MnFe2O4+xH2↑
MnFe2O4-X+xH20=MnFe2O4+xH2↑
(条件不写).(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.

反应X的化学方程式为
SO2+I2+2H2O=2HI+H2SO4
SO2+I2+2H2O=2HI+H2SO4
,该流程中循环使用的原料有SO2、I2
SO2、I2
.从理论上讲,该流程中,1mol原料水制得1
1
molH2.分析:(1)只要能减少自然资源的运用都属于“开源节流”.
(2)最节能的方法是运用太阳能.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质;根据水和氢气的关系式计算生成的氢气的量.
(2)最节能的方法是运用太阳能.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质;根据水和氢气的关系式计算生成的氢气的量.
解答:解:(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故选bcd.
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故选bcd.
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
点评:本题考查了化学反应方程式的书写等知识点,难度不大,会分析流程图是解本题的关键.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
 下列说法错误的是( )
下列说法错误的是( )