题目内容
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 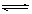 4C(s)
+2D(g)反应一段时间后达到平衡,测得生成1.6molC。则下列说法正确的是
4C(s)
+2D(g)反应一段时间后达到平衡,测得生成1.6molC。则下列说法正确的是
A.该反应的化学平衡常数表达式是K=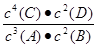
B.增加B,平衡向右移动,B的平衡转化率增大
C.此时,B的平衡转化率是40%
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
【答案】
C
【解析】
试题分析:A 由于固体物质的浓度在反应中不变,所以该反应的化学平衡常数表达式是K=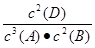 ,错误。B 增大反应物的浓度,平衡向正反应方向移动,使其它反应物转化率提高;但对该物质来说平衡移动消耗的该物质远远小于增加的该物质,所以这种物质的转化率反而降低。错误。C根据化学方程式可知生成1.6molC
,消耗B 0.8mol。则它的转化率是:0.8∕2×100℅=40%.正确。D对于一个确定的化学反应来说,化学平衡常数只与温度有关。错误。
,错误。B 增大反应物的浓度,平衡向正反应方向移动,使其它反应物转化率提高;但对该物质来说平衡移动消耗的该物质远远小于增加的该物质,所以这种物质的转化率反而降低。错误。C根据化学方程式可知生成1.6molC
,消耗B 0.8mol。则它的转化率是:0.8∕2×100℅=40%.正确。D对于一个确定的化学反应来说,化学平衡常数只与温度有关。错误。
考点:考查化学平衡常数的表达式、反应物的转化率的计算、外界条件对化学平衡的影响等的知识。

练习册系列答案
相关题目