题目内容
(1)在Fe3O4+4CO  3Fe+CO2的反应中,______是氧化剂,______是还原剂,______元素被氧化,______元素被还原.
3Fe+CO2的反应中,______是氧化剂,______是还原剂,______元素被氧化,______元素被还原.
(2)配平下列化学方程式并用双线桥法分析下列氧化还原反应中电子转移的方向和数目,
KClO3+HCl(浓)═KCl+ClO2↑+Cl2↑+H2O______
浓盐酸在反应中表现出来的性质是______(填写编号,多选倒扣).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
若得到标准状况下3.36LCl2,则参加反应的KClO3物质的量为______.
解:(1)在Fe3O4+4CO  3Fe+CO2的反应中,铁元素的化合价降低,则Fe3O4为氧化剂,Fe元素被还原,碳元素的化合价升高,则CO为还原剂,碳元素被氧化,
3Fe+CO2的反应中,铁元素的化合价降低,则Fe3O4为氧化剂,Fe元素被还原,碳元素的化合价升高,则CO为还原剂,碳元素被氧化,
故答案为:Fe3O4;CO;C;Fe;
(2)在KClO3+HCl(浓)═KCl+ClO2↑+Cl2↑+H2O中,KClO3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高到0,由电子守恒及质量守恒定律
可知,配平后的化学反应为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O,用双线桥法分析下列氧化还原反应中电子转移的方向和数目为 ,HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,即在该反应中HCl既有酸性又有还原性是②,
,HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,即在该反应中HCl既有酸性又有还原性是②,
标准状况下3.36LCl2的物质的量为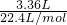 =0.15mol,由2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,参加反应的KClO3物质的量为0.15mol×2=0.3mol,
=0.15mol,由2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,参加反应的KClO3物质的量为0.15mol×2=0.3mol,
故答案为: ;②;0.3mol.
;②;0.3mol.
分析:(1)含元素化合价降低的物质为氧化剂,在反应中被还原,含元素化合价升高的物质为还原剂,在反应中被氧化;
(2)KClO3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平并标电子转移的方向和数目;
HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,再利用n=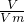 计算氯气的物质的量,根据反应方程式计算参加反应的KClO3物质的量.
计算氯气的物质的量,根据反应方程式计算参加反应的KClO3物质的量.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,并学会利用反应得出物质的物质的量的关系来解答即可,难度不大.
 3Fe+CO2的反应中,铁元素的化合价降低,则Fe3O4为氧化剂,Fe元素被还原,碳元素的化合价升高,则CO为还原剂,碳元素被氧化,
3Fe+CO2的反应中,铁元素的化合价降低,则Fe3O4为氧化剂,Fe元素被还原,碳元素的化合价升高,则CO为还原剂,碳元素被氧化,故答案为:Fe3O4;CO;C;Fe;
(2)在KClO3+HCl(浓)═KCl+ClO2↑+Cl2↑+H2O中,KClO3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高到0,由电子守恒及质量守恒定律
可知,配平后的化学反应为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O,用双线桥法分析下列氧化还原反应中电子转移的方向和数目为
 ,HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,即在该反应中HCl既有酸性又有还原性是②,
,HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,即在该反应中HCl既有酸性又有还原性是②,标准状况下3.36LCl2的物质的量为
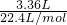 =0.15mol,由2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,参加反应的KClO3物质的量为0.15mol×2=0.3mol,
=0.15mol,由2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,参加反应的KClO3物质的量为0.15mol×2=0.3mol,故答案为:
 ;②;0.3mol.
;②;0.3mol.分析:(1)含元素化合价降低的物质为氧化剂,在反应中被还原,含元素化合价升高的物质为还原剂,在反应中被氧化;
(2)KClO3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平并标电子转移的方向和数目;
HCl参加反应生成盐时表现酸性,生成氯气时体现其还原性,再利用n=
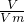 计算氯气的物质的量,根据反应方程式计算参加反应的KClO3物质的量.
计算氯气的物质的量,根据反应方程式计算参加反应的KClO3物质的量.点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,并学会利用反应得出物质的物质的量的关系来解答即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 3Fe+4CO2的反应中, 是氧化剂,
3Fe+4CO2的反应中, 是氧化剂, 3Fe+4CO2的反应中,
是氧化剂,
是还原剂,
元素被氧化,
元素被还原。
3Fe+4CO2的反应中,
是氧化剂,
是还原剂,
元素被氧化,
元素被还原。 3Fe+4CO2的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原.
3Fe+4CO2的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原.