题目内容
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出. 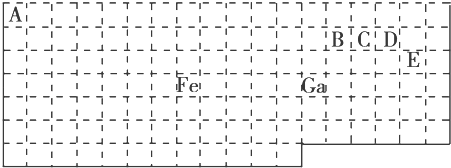
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的区;Fe和CO易形成配合物Fe(CO)5 , 在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为和(填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 . B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为(写2种).
【答案】
(1)4s24p1
(2)d;0
(3)N2;CN﹣
(4)CH4、CH3OH
(5)正四面体;CO2 CCl4
【解析】解:(1.)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;所以答案是:4s24p1;
(2.)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2 ,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0,所以答案是:d;0;(3.)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2 . 所以答案是:N2、CN﹣;
(4.)在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.所以答案是:CH4、CH3OH;
(5.)根据元素周期表知,E是Cl元素,D是O元素,ED4﹣是ClO4﹣离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+ ![]() (7+1﹣4×2)=4,根据VSEPR理论预测ED4﹣离子的空间构型为正四面体型.C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2 CCl4 , 所以答案是:正四面体;CO2 CCl4 .
(7+1﹣4×2)=4,根据VSEPR理论预测ED4﹣离子的空间构型为正四面体型.C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2 CCl4 , 所以答案是:正四面体;CO2 CCl4 .