题目内容
下列分子或离子属等电子体的是
| A.CH4和NH3 | B.NO3-和CO32- | C.H3O+ 和PCl3 | D.CS2和SO2 |
B
试题分析:原子总数和价电子总数分别都相同的分子或离子称为等电子体,等电子体间结构和性质相似(等电子原理)。A、甲烷分子中含有5个原子,氨气分子中含有4个原子,所以不是等电子体,故A错误;B、硝酸根离子和碳酸根离子都含有4个原子,其价电子数都是24,所以是等电子体,故B正确;C、H3O+和PCl3都含有4个原子,水合氢离子价电子数是8,PCl3价电子数是26,所以不是等电子体,故C错误;D、CS2和SO2分子中都含有3个原子,CS2中价电子数是16,SO2中价电子数是18,所以不是等电子体,故D错误,答案选B。

练习册系列答案
相关题目
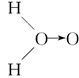 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。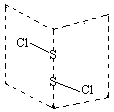
 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:
 、
、 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。