题目内容
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
A.11 B.5 C.7 D.1
【答案】
A
【解析】
试题分析:根据题意可知,阴极产生的气体为H2,阳极产生的气体为Cl2和O2,0.14molH2转移0.28mol电子,所以阴极还有Cu0.06mol。根据转移的电子数和产生气体的体积,可求得阳极产生Cl20.08mol,O20.06 mol。所以整个电解过程分为三段,第一阶段,阳极产生0.06molCl2,阴极产生0.06molCu,此时溶液的pH变化不大;第二阶段,阳极产生0.02molCl2,阴极产生0.02molH2,此时溶液中产生0.04molOH-,溶液的pH增大,第三阶段,阳极产生0.06molO2,阴极产生0.12molH2,此时溶液中OH-浓度基本不变,所以溶液中c(OH-)=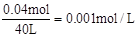 ,所以溶液的pH为11,答案选A。
,所以溶液的pH为11,答案选A。
考点:电解的计算
点评:本题难度较大,主要考查学生的分析能力。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案
相关题目