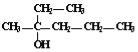题目内容
【题目】草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:
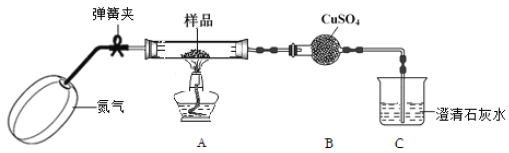
(1)实验开始前,鼓入氮气的目的是____________。
(2)实验中,装置B中的现象是 。
(3)装置C中可观察到的现象是_________,由此可知草酸晶体分解的产物中有_______。
(4)设计实验验证装置A中黑色残留物不含有Fe3O4 (简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。
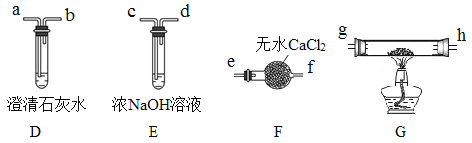
(5)乙组同学的实验装置中,依次连接的合理顺序为x→______g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是_______。能证明草酸晶体分解产物中有CO的现象是_______。
(6)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________。
【答案】
(1)排尽装置中的空气,以免生成的FeO被氧化(2分)
(2)白色固体变为蓝色(1分)
(3)有气泡逸出,澄清石灰水变浑浊(2分) CO2(1分)
(4)取少量装置A中固体残留物于试管中,加入稀硫酸溶解,然后滴加KSCN溶液,溶液不显红色,说明固体残留物中不含有Fe3O4(2分)
(5)c→d→a→b→e→f(2分) CuO(氧化铜)(1分)
G中的粉末由黑色变为红色,其后的D中的石灰水变浑浊(2分)
(6)未对尾气进行处理,可造成环境污染(1分)
【解析】
试题分析:
(1)生成的氧化亚铁易被氧化,因此鼓入氮气的目的是排尽装置中的空气,以免生成的FeO被氧化。
(2)无水硫酸铜检验水,因此实验现象是白色固体变为蓝色。
(3)澄清石灰水变浑浊,说明有CO2产生,考虑到还有CO,因此实验现象是有气泡逸出,澄清石灰水变浑浊。
(4)根据铁离子的性质检验四氧化三铁,即取少量装置A中固体残留物于试管中,加入稀硫酸溶解,然后滴加KSCN溶液,溶液不显红色,说明固体残留物中不含有Fe3O4。
(5)由装置A出来的气体含有CO2、CO,容易想到用灼热氧化铜来氧化CO,进而检验其产物CO2。但要注意到原产物中有CO2,故要设计除去CO2和验证CO2除尽的环节。最终确认连接顺序E(除CO2)、D(验证CO2被除尽)、F(干燥,这是气体进入加热装置的常规要求)、G(氧化CO)、D(验证G中生成的CO2来证明CO的存在),所以连接顺序是x→c→d→a→b→e→f→g→h→a。
(6)按照题目提供的装置和要求设计的实验没有尾气吸收装置,而一氧化碳有毒,会污染空气。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构及性质如下表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是______________;
(2)Z元素在周期表中的位置是__________________;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)_________________;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是:(用离子方程式表示)_______________________________;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式: __________________。