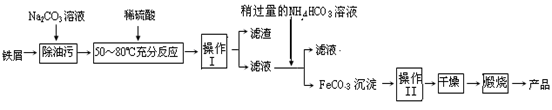
题目内容
取一定量的CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g. 并收集到224mL气体(标准状况)。求此CuO粉末的质量。
8 g
g
 g
g由题意可知,CuO粉末与稀硫酸充分反应后,硫酸过量。
引起铁棒质量变化时涉及到下列两个反应:
① Fe + H2SO4 =" " FeSO4 + H2
② Fe + CuSO4 =" " FeSO4 + Cu
其中第①个反应使铁棒质量减少,第②个反应使铁 棒质量增加,两者的代数和为0.24g。
棒质量增加,两者的代数和为0.24g。
① Fe + H2 SO4 =" " FeSO4 + H2 △m1
SO4 =" " FeSO4 + H2 △m1
56g 1mol 56g
0.01mol 0.56g
△ m2 -△m1 =" 0.24g. " △m2=△m1 +0.24g="0.56g+0.24g=0.80g"
设CuO的物质的量为x, CuSO4的物质的量也为x,
② Fe + CuSO4 =" " FeSO4 + Cu △m2
1mol 8g
X 0.80g
解得: X=0.1mol
m(CuO)= 0.1mol?80g/mol=8 g
g
引起铁棒质量变化时涉及到下列两个反应:
① Fe + H2SO4 =" " FeSO4 + H2
② Fe + CuSO4 =" " FeSO4 + Cu
其中第①个反应使铁棒质量减少,第②个反应使铁
 棒质量增加,两者的代数和为0.24g。
棒质量增加,两者的代数和为0.24g。① Fe + H2
 SO4 =" " FeSO4 + H2 △m1
SO4 =" " FeSO4 + H2 △m156g 1mol 56g
0.01mol 0.56g
△ m2 -△m1 =" 0.24g. " △m2=△m1 +0.24g="0.56g+0.24g=0.80g"
设CuO的物质的量为x, CuSO4的物质的量也为x,
② Fe + CuSO4 =" " FeSO4 + Cu △m2
1mol 8g
X 0.80g
解得: X=0.1mol
m(CuO)= 0.1mol?80g/mol=8
 g
g 
练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目

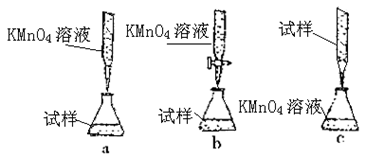
 气体成分也不同,气体成分可能含
气体成分也不同,气体成分可能含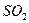 、
、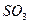 和
和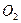 中的一种、两种或三种。下列叙述中错误的是( )
中的一种、两种或三种。下列叙述中错误的是( )