题目内容
【题目】【化学——物质结构与性质】
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个电子;C的基态原子2p能级有1个电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式________。基态A原子的第I电离能比B的大,其原因是____。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_________。
(3)A的最简单氢化物分子的空间构型为___________,其中A原子的杂化类型是_________。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为_________,加入乙醇的目的是____________。
②写出该配合物中配离子的结构简式___________。
(5)C和D形成的化合物的晶胞结构如图所示,则D的配位数是_______,已知晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,求晶胞边长a=________cm(含用ρ、NA的计算式表示)。

【答案】3d104s1基态氮原子的2p能级处于较稳定的半充满状态水分子间存在氢键,氢键比范德华力更强三角锥型sp3[Cu(NH3)4]SO4·H2O降低硫酸四氨合铜晶体的溶解度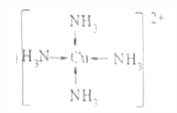 8
8
【解析】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素;
(1)Cu的核电荷数为29,基态Cu原子的电子排布式是1s22s22p63s23p63d104s1,则价电子排布式为3d104s1。基态N原子的核外电子排布为1s22s22p3,p轨道为半充满结构,较稳定,故其第I电离能比O的大;
(2)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的;
(3)NH3分子的空间构型为三角锥型,氨气分子中氮原子价层电子对个数=3+![]() (5-3×1)=4,所以N原子采用sp3杂化;
(5-3×1)=4,所以N原子采用sp3杂化;
(4)向CuSO4的水溶液中逐滴加入氨水,离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2H2O,至过量,观察到溶液由天蓝色最终变为深蓝色,生成[Cu(NH3)4]2+,反应的离子方程式为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
①该蓝色晶体的化学式为[Cu(NH3)4]SO4·H2O,加入乙醇的目的是向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4H2O,则加入乙醇的作用是降低了[Cu(NH3)4]SO4H2O的溶解度;
②[Cu(NH3)4]2+的结构式为![]() ;
;
(5)晶胞中顶点Ca最靠近的F共有8个,则Ca的配位数是8;白色球为F、黑色球为Ca,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×![]() +6×
+6×![]() =4,则晶胞质量=4×
=4,则晶胞质量=4×![]() g=
g=![]() g,晶胞的体积=
g,晶胞的体积=![]() g÷ρ gcm-3=
g÷ρ gcm-3=![]() cm3,故晶胞边长a=
cm3,故晶胞边长a=![]() cm。
cm。

【题目】纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:

已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。



