题目内容
【题目】纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:
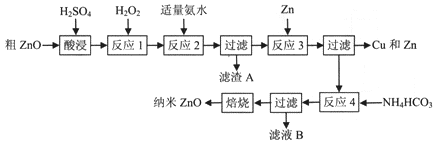
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。
【答案】适当增加酸的浓度、加热、将固体原料粉碎等2Fe2++H2O2+2H+=2Fe3++2H2O11.3调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去3.2≤pH<5.24.0×10—11mol/LZn+Cu2+ =Zn2++Cu置换反应(NH4)2SO42
【解析】(1)酸浸时,为了提高浸出率,可采取的措施有适当增加酸的浓度、加热、将固体原料粉碎等,故答案为:适当增加酸的浓度、加热、将固体原料粉碎等;
(2)反应1中,双氧水将溶解生成的硫酸亚铁氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;根据c=![]() =
=![]() =11.3 mol/L,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;11.3;
=11.3 mol/L,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;11.3;
(3)根据生成氢氧化物沉淀时溶液的pH,反应2中加适量氨水可以调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去,此时所需pH的范围为3.2≤pH<5.2,当调节溶液pH=5时,溶液中的c(Fe3+)=![]() =
=![]() =4.0×10—11mol/L,故答案为:调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去;3.2≤pH<5.2;4.0×10—11;
=4.0×10—11mol/L,故答案为:调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去;3.2≤pH<5.2;4.0×10—11;
(4)反应3中加入的锌与溶液中的铜离子发生置换反应,反应的离子方程式为Zn+Cu2+ =Zn2++Cu,故答案为:Zn+Cu2+ =Zn2++Cu;置换反应;
(5)根据流程图,滤液B中含有生成的(NH4)2SO4和过量的碳酸氢铵,因此可回收的主要物质是(NH4)2SO4,故答案为:(NH4)2SO4;
(6)焙烧Zna(OH)bCO3生成氧化锌、水蒸气和二氧化碳。16.2g氧化锌,生成的二氧化碳和水蒸气是质量为22.4g-16.2g=6.2g。
Zna(OH)bCO3![]() aZnO+
aZnO+![]() H2O+CO2
H2O+CO2
65a+17b+60 81a 9b+44
22.4g 16.2g 6.2g
则![]() =
=![]() =
=![]() ,解得a=2,b=2,故答案为:2。
,解得a=2,b=2,故答案为:2。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X