题目内容
下图是实验室中制备气体或验证气体性质的装置图
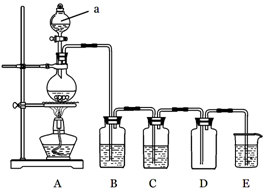
(1)仪器a的名称是 。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为 。
②装置B中的溶液为 ;烧杯中溶液的作用为 。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是 ,现象是 ;
②证明SO2具有还原性的现象是 ;
③证明生成气体中含有CO2的现象是 ;
④D装置的作用是 。

(1)仪器a的名称是 。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为 。
②装置B中的溶液为 ;烧杯中溶液的作用为 。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是 ,现象是 ;
②证明SO2具有还原性的现象是 ;
③证明生成气体中含有CO2的现象是 ;
④D装置的作用是 。
(1) 分液漏斗
(2)① MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
② 饱和NaCl溶液 ; 吸收氯气防污染
(3)① B , 品红褪色
② C中KMnO4溶液褪色
③ D中品红不褪色且石灰水变浑浊
④ 检验SO2是否除尽
(2)① MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
② 饱和NaCl溶液 ; 吸收氯气防污染
(3)① B , 品红褪色
② C中KMnO4溶液褪色
③ D中品红不褪色且石灰水变浑浊
④ 检验SO2是否除尽
(2)生成的氯气中会混有氯化氢和水蒸气,应先除杂,再干燥,故B中用饱和NaCl溶液除氯化氢,C用来干燥氯气,D用来收集氯气,E用来吸收多余的氯气,因氯气有毒,会污染环境
(3)①A中产生的气体为SO2 CO2的混合物,其中只有SO2能使品红褪色,故B装置能验证SO2的漂白性;②同理,只有SO2能表现出还原性,与酸性高锰酸钾溶液反应,而CO2不能;③证明生成气体中含有CO2,要先除掉SO2,因SO2也能使石灰水变浑浊,所以现象是D中品红不褪色且石灰水变浑浊,故D装置的作用是检验SO2是否除尽
(3)①A中产生的气体为SO2 CO2的混合物,其中只有SO2能使品红褪色,故B装置能验证SO2的漂白性;②同理,只有SO2能表现出还原性,与酸性高锰酸钾溶液反应,而CO2不能;③证明生成气体中含有CO2,要先除掉SO2,因SO2也能使石灰水变浑浊,所以现象是D中品红不褪色且石灰水变浑浊,故D装置的作用是检验SO2是否除尽

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目