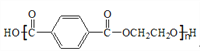
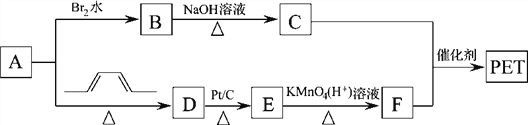
题目内容
【题目】有以下四种物质:①标况下11.2 L CO2 ②1 g H2,③1.204×1024个N2,④4℃时18 mL H2O,下列说法不正确的是
A. 体积:③>④>①=② B. 质量:③>①>④>②
C. 分子个数:③>④>①=② D. 原子个数:③>④>①>②
【答案】A
【解析】
①标况下11.2L CO2的物质的量为11.2L÷22.4L/mol=0.5mol;
②1g H2的物质的量为1g÷2g/mol=0.5mol;
③1.204×1024个N2的物质的量为![]() =2mol;
=2mol;
④4℃时18mLH2O的质量是18g,物质的量为18g÷18g/mol=1mol。
A、氢气与氮气所处状态不知道,不能计算体积,无法进行体积比较,A错误;
B、各物质的质量为:①0.5mol×44g/mol=22g;②1g;③2mol×28g/mol=56g;④18mL×1g/mL=18g,所以质量大小为③>①>④>②,B正确。
C、物质的量大小为③>④>①=②,分子数目之比等于物质的量之比,分子个数③>④>①=②,C正确;
D、各物质中原子的物质的量为:①0.5mol×3=1.5mol;②0.5mol×2=1mol;③2mol×2=4mol④1mol×3=3mol,所以原子的物质的量③>④>①>②,原子数目之比等于物质的量之比,所以原子个数③>④>①>②,D正确;
答案选A。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】加成反应是有机化学中的一类重要的化学反应,下列属于加成反应的是( )
A.甲烷与氯气混合后在光照条件下反应
B.乙烯与溴的四氯化碳溶液反应
C.乙烯使酸性高锰酸钾溶液褪色
D.在苯中滴入溴水,溴水褪色
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
(1)乙醇、乙酸和浓硫酸的加入顺序是___________。制取乙酸乙酯的反应原理为:__________________________________。

(2)为证明浓硫酸在该反应中起到了______和________的作用, 为证明其作用,某同学利用上图所示装置进行了以下四个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
实验编 号 | 试管I中的试剂 | 试管II中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL18mo/L浓硫酸 | 5.0 | |
B | 3mL乙醇、2mL乙酸 | 饱和碳酸钠溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_____mL和_____mol/L。
②分析实验_______(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________。
(3)饱和碳酸钠溶液的作用是溶解没有反应的乙醇,除去没有反应的乙酸和___________,本实验装置有明显的缺陷,其可能造成的后果是__________________________。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是_______________。
(5)分离饱和碳酸钠溶液和乙酸乙酯的方法是_________。