题目内容
16.一定温度下某固定容积的密闭容器中,可逆反应N2(g)+3H2(g)?2NH3(g) 达平衡的标志是( )| A. | 1个N≡N键断裂的同时,有6个N-H键形成 | |
| B. | 混合气体的密度不再改变 | |
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | |
| D. | N2、H2、NH3的体积比为1:3:2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.无论反应是否达到平衡状态都存在1个N≡N键断裂的同时、有6个N-H键形成,所以不能据此判断平衡状态,故A错误;
B.反应前后气体质量不变、容器体积不变,则密度始终不变,所以不能据此判断平衡状态,故B错误;
C.v正(H2)=$\frac{3}{2}$ v逆(NH3)=v逆(H2),所以正逆反应速率相等,该反应达到平衡状态,故C正确;
D.N2、H2、NH3的体积比为1:3:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始浓度及转化率有关,故D错误;
故选C.
点评 本题考查化学反应平衡状态判断,为高频考点,当反应前后改变的物理量不变时改反应达到平衡状态,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.

练习册系列答案
相关题目
8.在镀锌铁皮的锌镀层厚度的测定过程中,下列操作会导致测定结果偏高的是( )
| A. | 过早判断反应终点 | |
| B. | 在测定铁皮的面积时测得面积比铁皮的实际面积大 | |
| C. | 过迟判断反应终点 | |
| D. | 锌在酸中溶解后,铁皮未烘干就去称重 |
5.下列各组物质中,从物质分类的角度看,后者从属于前者的是( )
| A. | 纯净物、混合物 | B. | 金属、非金属 | C. | 纯净物、化合物 | D. | 含氧酸、无氧酸 |
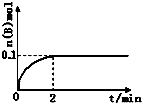
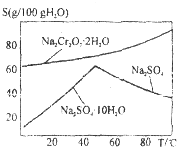 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
 ;
; 结构(含E)的有13种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为
结构(含E)的有13种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为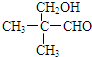 .
.



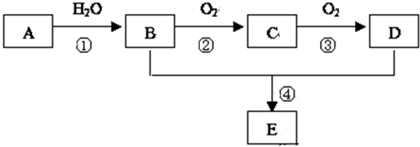
 .
.