题目内容
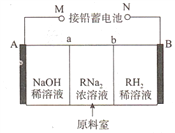
【题目】以铅蓄电池为电源.通过电解法制备酒石酸(C4H606,简写为RH2)的原理如图所示(A、B为惰性电极,a、b为离子交换膜)
下列叙述不正确的是
A. N极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B. b为阴离子交换膜
C. 阴极反应为2H20+2e-=H2↑+20H-,阴极区溶液pH升高
D. 铅蓄电池中消耗2molH2SO4时,理论上生成2molRH2
【答案】D
【解析】电解目的为制备RH2,则装置右侧为产品室,若原料室中的R2-通过阴离子交换膜进入产品室与H+结合,则可制得RH2。所以B极应为H2O中的OH-放电,生成H+,即B极为阳极,电极反应为:2H2O-4e-= O2↑+4H+,b为阴离子交换膜,N为正极,M为负极,A为阴极。A、N为铅蓄电池正极,电极反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,故A正确;B、根据上述分析可知,b为阴离子交换膜,故B正确;C、阴极应为H2O中的H+放电,生成OH-,故电极反应为:2H20+2e-=H2↑+20H-,0H-浓度增大,pH增大,故C正确;D、铅蓄电池放电时总反应为:Pb+ PbO2+2H2SO4=2PbSO4+2H20,当电池中消耗2mol H2SO4时,则电路中转移2mol e-。根据B极电极反应2H2O-4e-= O2↑+4H+,可知,转移2mol e-,原料室有2mol H+生成,R2- +2H+= RH2,所以理论上可生成1mol RH2,故D错误。故选D。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
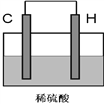
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。