题目内容
14.下列有关物质性质的比较顺序中,不正确的是( )| A. | 热稳定性:H2O<H2S<H2Se | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:Li>Na>K>Rb |
分析 A、元素的非金属性越强,对应的氢化物越稳定;
B、电子层数越多半径越大,电子层结构相同时,原子序数越大,半径越小;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、碱金属元素的单质,原子序数越大,熔沸点越低.
解答 解:A、同主族元素从上往下非金属性减弱,所以稳定性:H2O>H2S>H2Se,故A错误;
B、电子层数越多半径越大,电子层结构相同时,原子序数越大,半径越小,钾离子三个电子层而Na+、Mg2+、Al3+有两个电子层,电子层结构相同,所以微粒半径:K+>Na+>Mg2+>Al3+,故B正确;
C、非金属性Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D、碱金属元素的单质,原子序数越大,原子半径越大,熔沸点越低,则单质熔点:Li>Na>K>Rb,故D正确;
故选A.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度不大,本题注意把握元素周期律的递变规律,注重基础积累的积累即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
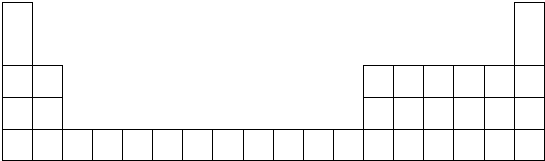
4.根据下表信息回答以下问题(均为短周期元素):
(1)在下表中用元素符号标出A、B、C、F的位置
(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |

(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
9.若某基态原子的外围电子排布为3d34s2,则下列说法正确的是( )
| A. | 该元素基态原子中共有13个电子 | B. | 该元素原子核外有3个电子层 | ||
| C. | 该元素原子最外层共有5个电子 | D. | 该元素原子L能层共有8个电子 |
2.在NH3•H2O?NH4++OH-形成的平衡中,要使NH3•H2O的电离程度及[OH-]都增大,可采取的措施是( )
| A. | 通入HCl | B. | 加少量NaOH固体 | C. | 加水 | D. | 升温 |
9.下列化学方程式书写不正确的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SiO2+H2O═H2SiO3 | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | 2H2S+SO2═3S+2H2O |
6.对于反应:N2(g)+3H2(g)?2NH3(g),△H<0 的平衡体系,在其它条件不变时,采取下列措施,其中能既使正、逆反应速率增大,又能使反应物转化率增大的是( )
| A. | 增大体系压强 | B. | 升温 | C. | 加入铁触媒 | D. | 减小NH3的浓度 |
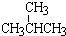 和
和 ; ⑧
; ⑧
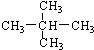 .
. 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.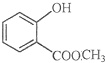 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.