题目内容
下列说法正确的是
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g)  4SO3(g)的△H相等 4SO3(g)的△H相等 |
C
解析试题分析:A、未标明状态,故无法确定;B、沸水pH在6左右,冰水的大于7,25℃等于7;C、正确。D选项,后者为前者的二倍。
考点:阿伏伽德罗常数,PH值,中和反应,焓变。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列叙述中,正确的是
| A.1 mol 过氧化钠中阴离子个数为2×6.02×1023 |
| B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 |
| C.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 |
| D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
下列有关化学用语表示正确的是
A.中子数为20的氯原子,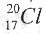 |
B.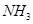 分子的电子式: 分子的电子式: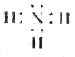 |
C.铝离子结构示意图: |
D.比例模型 表示甲烷分子或四氯化碳分子 表示甲烷分子或四氯化碳分子 |
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )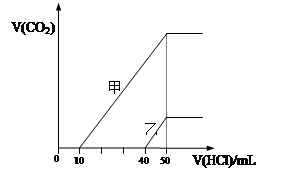
| A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
| B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O |
| C.乙溶液中含有的溶质是NaOH、NaHCO3 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况) |
两种金属混合物19.6克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)的氢气,此金属混合物不可能是
| A.Mg和Al | B.Al和Fe | C.Mg和Cu | D.Fe和Zn |
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.②⑤ | B.②③⑥ | C.①⑤⑥ | D.③⑥ |
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:
2FeCl3 + Cu = 2FeCl2 + CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
| A.0.5mol·L—1 | B.1.5 mol·L—1 | C.0.4 mol·L—1 | D.0.25 mol·L—1 |
下列溶液中含Cl—的物质的量浓度最大的是( )
| A.50mL0.5mol/LKCl溶液 | B.200mL0.3mol/LMgCl2溶液 |
| C.100mL0.25mol/LAlCl3溶液 | D.500mL0.5mol/LHCl溶液 |