题目内容
【题目】氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀
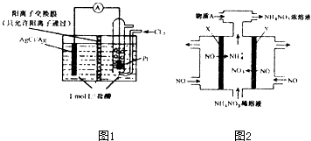
(2)如图1所示的原电池装置中,负极的电极反应为_________________;H+的移动方向为_____________电池总反应方程式为_________________当电路中转移0.1mole-时,交换膜左侧溶液中减少的质量为_____________.
(3)电解NO制备NH4NO3原理如图2所示,接电源正极的电极为___________(填X或Y),X电极反应式为_____________为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为_______________.
【答案】
(1)化学
(2)Ag-e-+Cl-=AgCl;从左向右;2Ag+Cl2=2AgCl;3.65g
(3)Y;NO+5e-+6H+=NH4++H2O;NH3
【解析】
试题分析:(1)Ag和硫化氢反应生成Ag2S,属于化学腐蚀;故答案为:化学;
(2)该原电池中,Ag易失电子作负极、通入氯气的电极为正极,负极反应式为Ag-e-=Ag+;电解质溶液中氢离子向正极Pt电极方向移动,该原电池相当于氯气和Ag的反应生成AgCl,电池反应式为2Ag+Cl2=2AgCl;放电时,左侧装置中Ag失电子和氯离子反应生成AgCl沉淀,且溶液中氢离子向正极移动,当电路中转移0.1mole-时,生成0.1mol银离子,0.1mol银离子生成AgCl需要0.1molCl-,向正极方向移动0.1molH+,所以交换膜左侧溶液中减少的离子为0.1molCl-和0.1molH+,减少的质量为0.1mol×36.5g/mol=3.65g,故答案为:Ag-e-=Ag+;从左向右;2Ag+Cl2=2AgCl;3.65;
(3)根据图片知,左侧NO得电子生成铵根离子,由此NO失电子生成硝酸根离子,最终得到硝酸铵,该电解池中失电子的电极为阳极、得电子的电极为阴极,所以X为阴极、Y为阳极,阳极接电源正极,所以Y接正极,X电极反应式为NO+5e-+6H+=NH4++H2O;根据转移电子相等时,生成一个铵根离子需要得到5个电子、生成一个硝酸根离子需要失去3个电子,根据转移电子相等知,生成铵根离子浓度小于硝酸根离子浓度,要使硝酸根离子完全转化为硝酸铵,应该加入氨气,所以加入的A为NH3,故答案为:Y;NO+5e-+6H+=NH4++H2O;NH3。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】T℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)![]() 2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75Q kJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是
A.容器①、②中反应的平衡常数均为18
B.容器②中达到平衡时放出的热量为0.05Q kJ
C.向容器①中通入氦气,平衡时A的转化率变大
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3