题目内容
1.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;IO3-→I2;HNO2→NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A. | .Fe3+ | B. | MnO4- | C. | IO3- | D. | HNO2 |
分析 氧化还原反应中遵循得失电子守恒,在四个反应中氧化剂不一样,而还原剂均为碘化钾中的碘离子,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的也就是比较每1mol氧化剂得电子的多少,得电子多的生成的I2就多,但IO3-的还原产物也为碘,以此来解答.
解答 解:氧化I-时,Fe3+→Fe2+得到1个电子,MnO4-→Mn2+得到5个电子,HNO2→NO得到1个电子,IO3-→I2得到5个电子,
I-→I2失去1个电子,
则B、C得电子较多,但IO3-由于也被还原为I2,则得到I2最多的是IO3-,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素化合价的变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意选项D中碘酸根离子被还原生成碘单质为本题的易错点,题目难度不大.

练习册系列答案
相关题目
11. 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱,MOH是一种弱碱 | B. | 在x点,c(M+)=c(R+) | ||
| C. | 稀释前,c(ROH)<10c(MOH) | D. | 稀释前,c(ROH)=10c(MOH) |
16.某同学向一支空试管中按一定的顺序分别加入下列四种物质 (一种物质只加一次):
①KI溶液 ②淀粉溶液 ③NaOH溶液 ④新制氯水.发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色.依据溶液颜色的变化判断加入以上物质的顺序是( )
①KI溶液 ②淀粉溶液 ③NaOH溶液 ④新制氯水.发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色.依据溶液颜色的变化判断加入以上物质的顺序是( )
| A. | ①→②→③→④ | B. | ①→④→②→③ | C. | ②→④→①→③ | D. | ①→②→④→③ |
6.下列关于苯的叙述中,正确的是( )
| A. | 苯在一定条件下能与浓硝酸发生加成反应生成硝基苯 | |
| B. | 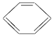 表示苯的分子结构,其中含有碳碳单键和碳碳双键,因此苯的性质跟乙烯的相似 表示苯的分子结构,其中含有碳碳单键和碳碳双键,因此苯的性质跟乙烯的相似 | |
| C. | 苯的分子式为C6H6,分子中氢原子个数比较少,能和溴水反应 | |
| D. | 苯分子的碳环为平面正六边形结构,6个碳原子之间的键完全相同 |
11.已知C4H10的同分异构体有两种,则C4H9Cl的同分异构体共有( )
| A. | l种 | B. | 2种 | C. | 3种 | D. | 4种 |
 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.