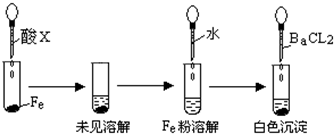
题目内容
盐酸、硫酸和硝酸是中学阶段常见的三种强酸.请就三者与金属铜的反应情况,回答下列问题:
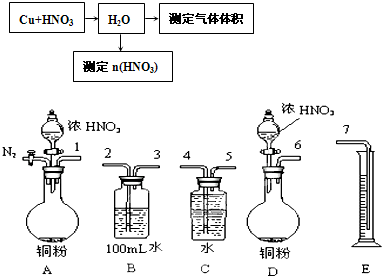
(1)①在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B. 6.72L C.20.16L D.30.24L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
A. 0.25mol B. 0.2mol C.0.15mol D.0.1mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为
(1)①在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
B
B
A.40.32L B. 6.72L C.20.16L D.30.24L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
NO2、NO
NO2、NO
,反应中所消耗的硝酸的物质的量可能为C
C
.A. 0.25mol B. 0.2mol C.0.15mol D.0.1mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为
Cu+H2O2+2HCl=CuCl2+2H2O
Cu+H2O2+2HCl=CuCl2+2H2O
.分析:(1)①根据铜只能和浓硫酸反应和稀硫酸不反应的性质判断;
②加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸能氧化铜;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸.
②加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸能氧化铜;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸.
解答:解:(1)①铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O,浓硫酸的物质的量为0.1L×18mol/L=1.8mol,如被还原的硫酸是0.9mol,则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,只有B符合,故答案为:B;
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,溶液中形成稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;气体的物质的量为
=0.05mol,当生成气体全部为NO2时,消耗的硝酸的物质的量为0.05mol×2=0.10mol,当生成气体全部为NO时,消耗的硝酸的物质的量为0.05mol×4=0.20mol,所以消耗的硝酸的物质的量介于0.10mol和0.20mol之间,只有C符合,故答案为:NO2、NO;C;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的方程式为Cu+H2O2+2HCl=CuCl2+2H2O;
故答案为:Cu+H2O2+2HCl=CuCl2+2H2O.
| ||
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,溶液中形成稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;气体的物质的量为
| 1.12L |
| 22,4L/mol |
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的方程式为Cu+H2O2+2HCl=CuCl2+2H2O;
故答案为:Cu+H2O2+2HCl=CuCl2+2H2O.
点评:本题考查了硝酸和硫酸的性质,化学方程式的书写和判断,掌握它们的化学性质是解答的关键,题目难度中等.

练习册系列答案
相关题目
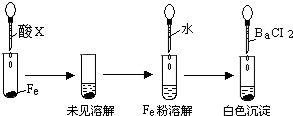 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题: