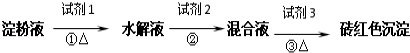
题目内容
【题目】将一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6 L(在标准状况下)。将反应后的溶液稀释到1 L,测得溶液的c(H+)=0.1 mol·L-1,则下列叙述不正确的是( )
A. 气体Y中SO2和H2的体积比为4∶1 B. 气体Y是SO2和H2的混合物
C. 反应中共消耗锌97.5 g D. 反应中共转移电子3 mol
【答案】A
【解析】将反应后的溶液稀释到1 L,测得溶液的c(H+)=0.1 mol·L-1,说明剩余稀硫酸是0.05mol。Zn和浓H2SO4反应生成SO2,随着反应的进行,浓H2SO4的浓度降低,变成稀H2SO4,此时生成H2,方程式分别是Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,此时生成33.6L÷22.4L/mol=1.5 mol气体,则转移电子为3 mol,消耗的Zn为1.5 mol,m(Zn)=65 g·mol-1×1.5 mol=97.5 g,根据硫原子守恒可知n(SO2)=1.85 mol-0.05 mol-1.5 mol=0.3 mol,n(H2)=1.5 mol-0.3 mol=1.2 mol。A.气体Y为SO2和H2的混合物,且V(SO2):V(H2)=1:4,A错误;B.由以上分析可知气体Y为SO2和H2的混合物,B正确;C.根据以上分析可知反应中共消耗金属Zn的质量是97.5g,C正确;D.根据以上分析可知反应中共转移3mol电子,D正确,答案选A。
ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,此时生成33.6L÷22.4L/mol=1.5 mol气体,则转移电子为3 mol,消耗的Zn为1.5 mol,m(Zn)=65 g·mol-1×1.5 mol=97.5 g,根据硫原子守恒可知n(SO2)=1.85 mol-0.05 mol-1.5 mol=0.3 mol,n(H2)=1.5 mol-0.3 mol=1.2 mol。A.气体Y为SO2和H2的混合物,且V(SO2):V(H2)=1:4,A错误;B.由以上分析可知气体Y为SO2和H2的混合物,B正确;C.根据以上分析可知反应中共消耗金属Zn的质量是97.5g,C正确;D.根据以上分析可知反应中共转移3mol电子,D正确,答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 , 其离子的原子结构示意图为
(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式: .
(3)按要求写出下列两种物质的电子式:①的单质;⑨的过氧化物;
(4)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
(5)请用电子式表示④和⑩组成的化合物的形成过程 .