题目内容
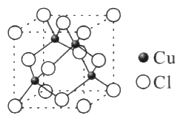
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。下图所示为超氧化钾晶体的一个晶胞,则下列说法中正确的是
| A.晶体中,0价氧与-2价氧的数目比为2:1 |
| B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C.晶体中与每个K+距离最近的K+有8个 |
| D.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
D
解析试题分析:A、晶胞中K+与O2-个数分别为4、4,所以晶胞中共有8个氧原子,根据电荷守恒-2价O原子数目为2,所以0价氧原子数目为8-2=6,所以晶体中,0价氧原子与-2价氧原子的数目比为3:1,故A错误;B、由晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,故B错误;C、由晶胞图可知,晶体中与每个K+距离最近的K+有12个,故C错误;D、由晶胞图可知,K+的个数为8×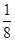 +6×
+6×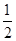 =4,O2-的个数为12×
=4,O2-的个数为12×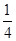 +1=4,化学式为KO2,故D正确;故选D。
+1=4,化学式为KO2,故D正确;故选D。
考点:考查晶胞结构,侧重于学生的观察与空间想象能力

 出彩同步大试卷系列答案
出彩同步大试卷系列答案三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”“P” “d”或“ds”等)区元素,位于 族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
下面有关晶体的叙述中,不正确的是( )
| A.金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
科学家最近又发现了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( )
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
下列各组物质的熔沸点按由低到高的顺序排列正确的是
| A.冰、干冰、氯化钠、金刚石 | B.汞、钠、烧碱、二氧化硅 |
| C.NaCl、KCl、CsCl | D.H2O、H2S、H2Se、H2Te |
下列性质适合于分子晶体的是( )。
| A.熔点1 070 ℃,易溶于水,水溶液能导电 |
| B.熔点10.31 ℃,液态不导电,水溶液导电 |
| C.难溶于CS2,熔点1 128 ℃,沸点4 446 ℃ |
| D.熔点97.81 ℃,质软导电,密度0.97 g·cm-3 |