题目内容
已知反应3H2+N2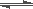 2NH3为放热反应,由此推断出 ( )
2NH3为放热反应,由此推断出 ( )
| A.氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应 |
| B.3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量 |
| C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量 |
| D.氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质 |
C
解析

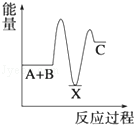
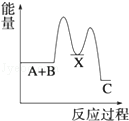
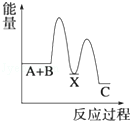
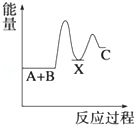
分析下图的能量变化示意图,下列选项正确的是
| A.2C====2A+B;ΔH>0 |
| B.2A+B====2C;ΔH>0 |
| C.2C(g)="===" 2A(g)+B(g);ΔH<0 |
| D.2A(g)+B(g)====2C(g);ΔH<0 |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) △CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
| A.△H2>△H3 | B.△H1<△H3 |
| C.△H1+△H3 =△H2 | D.△H1+△H2>△H3 |
某反应过程能量变化如图所示,下列说法正确的是
| A.反应过程a有催化剂参与 |
| B.该反应为放热反应,热效应等于ΔH |
| C.改变催化剂,可改变该反应的活化能 |
| D.有催化剂条件下,反应的活化能等于E1+E2 |
已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 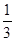 CO(g)
CO(g)
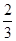 Fe3O4(s)+
Fe3O4(s)+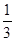 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1 mol H2中的化学键消耗
的能量为Q1kJ,断裂1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学
键释放的能量为Q3 kJ。下列关系式中一定正确的是
| A.Q1+Q2<Q3 | B.Q1+Q2>2Q3 |
| C.Q1+Q2=2Q3 | D.Q1+Q2<2Q3 |
下列说法中正确的是( )
| A.伴有能量变化的物质变化都是化学变化 | B.物质发生化学反应一定伴随着能量变化 |
| C.吸热反应在常温下不能发生 | D.放热反应的发生无需任何条件 |
已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为
| A.吸收183kJ | B.吸收366kJ | C.放出183kJ | D.放出366kJ |