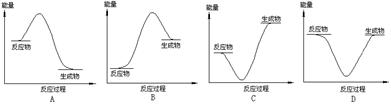
题目内容
某反应过程能量变化如图所示,下列说法正确的是
| A.反应过程a有催化剂参与 |
| B.该反应为放热反应,热效应等于ΔH |
| C.改变催化剂,可改变该反应的活化能 |
| D.有催化剂条件下,反应的活化能等于E1+E2 |
B C
解析试题分析:A.由图示可知反应过程a需要的活化能较高,没有催化剂参与。错误。B.由于反应物的能量高于生成物的能量,多余的能量就以热能的形式释放出来。所以该反应为放热反应,热效应等于反应物与生成物能量的差值ΔH。正确。C.改变催化剂,改变了反应途径,降低了反应的活化能,但是反应热不变。正确。D.无论是否存在催化剂,反应的活化能等于反应物与生成物的能量的差值,等于ΔH。错误。
考点:考查化学反应途径的知识。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是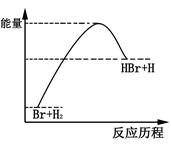
| A.正反应为吸热反应 |
| B.该反应的逆反应是吸热过程 |
| C.HBr的能量一定高于H2的能量 |
| D.反应物具有的总能量大于生成物具有的总能量 |
下列过程需要吸热的是 ( )
| A.H2→2H | B.Fe + S  FeS FeS | C.CaO + H2O = Ca(OH)2 | D.2Cl→Cl2 |
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
下列设备工作时,将化学能转化为热能的是
| A | B | C | D |
 |  |  |  |
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则CO(g)+H2O(g)
 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H= (3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=___________
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是 ( )
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
已知反应3H2+N2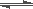 2NH3为放热反应,由此推断出 ( )
2NH3为放热反应,由此推断出 ( )
| A.氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应 |
| B.3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量 |
| C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量 |
| D.氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质 |