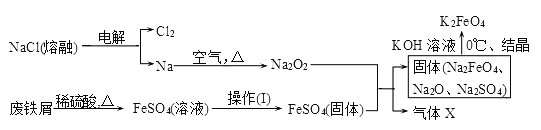
题目内容
【题目】摩尔盐易[(NH4)2Fe(SO4)2]易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是______(利用简要文字和必要的离子方程式说明),配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和_______;
(2)“步骤2”中所用废铁屑必须过量,原因是______________;
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、______、过滤、洗涤、干燥;
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为___________;
② 产品中Fe2+的质量分数为_________;
③ 滴定过程中.左手控制________,右手摇动锥形瓶,直到_________时停止滴定,读数。此时若俯视读数.测定结果将偏________(填“高”或“低”)。
【答案】 使平衡CO32-+H2O![]() HCO3-+OH-右移,增强溶液碱性 天平 防止产生Fe3+,保证所制摩尔盐的纯度 冷却结晶 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 14% 酸式滴定管的活塞 溶液出现浅紫色且半分钟内不褪色 低
HCO3-+OH-右移,增强溶液碱性 天平 防止产生Fe3+,保证所制摩尔盐的纯度 冷却结晶 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 14% 酸式滴定管的活塞 溶液出现浅紫色且半分钟内不褪色 低
【解析】(1)加热是为了促进CO32―的水解,提高碱性,CO32-+H2O![]() HCO3-+OH-;配制100g10%的Na2CO3溶液需要的仪器除药匙、量筒、烧杯、玻璃棒外,还要称一定质量的Na2CO3固体,所以还要天平;
HCO3-+OH-;配制100g10%的Na2CO3溶液需要的仪器除药匙、量筒、烧杯、玻璃棒外,还要称一定质量的Na2CO3固体,所以还要天平;
(2)“步骤2”中所用废铁屑必须过量,防止产生Fe3+,保证所制摩尔盐的纯度,Fe+2Fe3+=3Fe2+ ;(3)用降温结晶的方法,步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(4)①e2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2++系数为5,MnO4-系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,
所以反应离子方程式为5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O②令4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.2mol·L-1
所以x=0.01L× 0.2mo1·L-1 ×5/1=0.01mol.
所以4g产品中Fe2+的质量0.01mol×56g·mol-1=0.56g,所以4g产品中Fe2+的质量分数为0.56g/4g×100%=14%.故答案为:14%
③滴定过程中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,直到溶液出现浅紫色且半分钟内不褪色。溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点。此时若俯视读数,读出的高锰酸钾溶液体积偏小,测定结果将偏低。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。