��Ŀ����
����Ŀ���Ӷ��Է����������о��Ǹ�������ѧѧϰ����Ҫ��չ���̡����������ѧ֪ʶ�����»�ѧ������ж���������
��1�����������һ�ֵ��͵�ǿ������������KMnO4������Һ����CuS�Ļ����ʱ�������ķ�Ӧ���£�6 MnO4��+5 CuS + 28H+ = 5Cu2+ + 5SO2�� +6 Mn2+�� 14H2O�����õ����ŷ�����÷�Ӧ�е���ת�Ƶķ������Ŀ��
6 MnO4��+5 CuS + 28H+ = 5Cu2+ + 5SO2�� +6 Mn2+�� 14H2O ________________
��2������������ײʱ����ȫ�����з�����Ӧ10NaN3��2KNO3=K2O��5Na2O��16N2��������������Ȼ�ԭ�����1.75 mol�� ��ת�Ƶĵ�����Ϊ__________�� ��������Nԭ�ӵ����ʵ���Ϊ__________��
��3��ʵ������ҪΪ������������1 L�ں�0.24 mol K2SO4��0.5 mol NH4Cl��0.16 mol KCl��ijӪ��Һ��ijС��ƻ���(NH4)2SO4��KCl��NH4Cl���ƣ����������ֹ�������ʵ����ֱ�Ϊ_________��_________��_________��
���𰸡� ![]() 1.25 NA ��1.25��6.02��1023��7.525��1023�� 3.75 mol 0.24moL 0.64moL 0.02moL
1.25 NA ��1.25��6.02��1023��7.525��1023�� 3.75 mol 0.24moL 0.64moL 0.02moL
����������1���õ����ŷ�����÷�Ӧ�е���ת�Ƶķ������Ŀ������
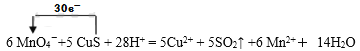 ��
��
��2��10NaN3��2KNO3=K2O��5Na2O��16N2�������Ӧ�����������������������ǻ�ԭ����������16mol��������������������15mol����ԭ������1mol����������Ȼ�ԭ�����14mol������ת��10mol������������Ȼ�ԭ�����1.75 mol�� ��ת�Ƶĵ��ӵ����ʵ���Ϊ![]() ��ת�Ƶĵ�����Ϊ1.25 NA��1.25��6.02��1023��7.525��1023���� ��������Nԭ����NaN3�е�N�������ʵ���Ϊ��ת�Ƶ��ӵ�3������3.75 mol ��
��ת�Ƶĵ�����Ϊ1.25 NA��1.25��6.02��1023��7.525��1023���� ��������Nԭ����NaN3�е�N�������ʵ���Ϊ��ת�Ƶ��ӵ�3������3.75 mol ��
��3������1 L�ں�0.24 mol K2SO4��0.5 mol NH4Cl��0.16 mol KCl��ijӪ��Һ�����к�������0.64mol���������0.24mol����笠�0.5mol����������0.66mol������(NH4)2SO4��KCl��NH4Cl���ƣ����������غ�������������ֹ�������ʵ����ֱ�Ϊ0.24moL��0.64moL��0.02moL��






