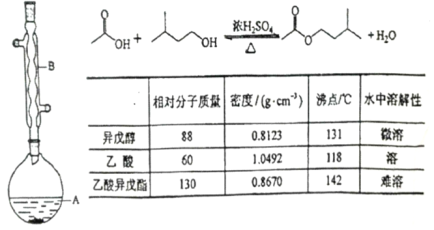
��Ŀ����
����Ŀ����֪ij���������к���NaCl���ʣ�Ϊ�ⶨ�����д��������������������ͼ�е�װ�ý���ʵ�飺
��Ҫ�������£�
����ͼ��װ�����������װ�õ�������
����a g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ
������ʢ�м�ʯ�ҵ�U�ιܵ��������õ�b g
���ӷ�Һ©������6mol��1-1�����ᣬֱ�����ٲ�������ʱΪֹ
���ӵ���A����������һ�����Ŀ���
���ٴγ���ʢ�м�ʯ�ҵ�U�ܵ��������õ�c g
�� �ظ������������IJ���һֱ��U�ܵ������������䣬Ϊd g
����պͻش����⣺
��1������������ƽ������Ʒʱ�������ƽ��ָ������ƫת��˵��
��2��װ���и����B��������
��3���������Һ©���е����ỻ��Ũ����ͬ�����ᣬ���ԵĽ�� ����ƫ�ߡ�ƫ�ͻ䣩
��4����������Ŀ����
��5����������Ŀ����
��6���������д�������������ļ���ʽΪ
��7��������������ʵ�鷽���ⶨ�����д�������������������һ�ֲ�ͬ��ʵ�鷽��
���𰸡���1����Ʒ�أ��������2����ֹ�����е�CO 2��ˮ��������U�ι��У���3��ƫ�ߣ���4���ѷ�Ӧ������CO 2 ȫ������U�ι��У���5���жϷ�Ӧ������CO 2�Ƿ�ȫ���ų�������U�ι��еļ�ʯ�����գ���6��![]() ����7��ֱ�ӲⶨNa 2 CO 3 ����������ʹCO 3 2- ��������CaCO 3 ����������Na 2 CO 3 ��������
����7��ֱ�ӲⶨNa 2 CO 3 ����������ʹCO 3 2- ��������CaCO 3 ����������Na 2 CO 3 ��������
��������
�����������1��ָ������ƫת��˵����Ʒ�����������룻��2����ֹ������ˮ������CO2����U�ιܣ���ֹ�������ţ���3��Na2CO3��2HCl=2NaCl��CO2����H2O��U�����ղ�����CO2������CO2�������̼���Ƶ���������������ᣬ����ӷ�������U�ܣ�����CO2����������̼���Ƶ�����������ֵƫ�ߣ���4����ƿ��ϴ��ƿ�д��в���δ�����յ�CO2��Ϊ�˼�����ͨһ��ʱ���N2����CO2ȫ�����գ���������5�� �жϷ�Ӧ������CO 2 �Ƿ�ȫ���ų�������U�ι��еļ�ʯ�����գ���6��CO2������Ϊ(d��b)g������̼Ԫ���غ㣬Na2CO3�����ʵ���Ϊ(d��b)/44mol��̼���Ƶ���������Ϊ106(d��b)/44��100%����7����Һ�м���BaCl2��Һ�������������Գ���ϴ�ӡ�����������õ�����������������̼Ԫ���غ㣬�����̼���Ƶ�������