��Ŀ����
������ҵ�ƴ���ʱ����һ����ͨ������ʳ��ˮ������CO2��Ӧ�����NaHCO3�ᾧ�����ķ�Ӧԭ������������ķ���ʽ��ʾ��
����NH3��CO2��H2O��NH4HCO3
����NH4HCO3��NaCl(����)��NaHCO3��NH4Cl
������������Ӧ����ͬһ����Ӧ������ɵģ����ܽ���Ƿ��ȷ�Ӧ��
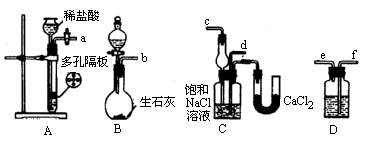
����ij�о���ѧϰС������ͼ��ʵ��װ��ģ��ʵ����һ���̣������NaHCO3�ᾧ��
������ѡ�õ�ʵ����Ʒ�У���6mol��L��1�����ᡢ��6mol��L��1�����ᡢ��Ũ��ˮ����10��������������Һ���ݳ���ʯ��ˮ����ʯ��ʯ����ʳ�Ρ�������ˮ�����ˮ�ۡ�����������������
��ش��������⣺
(1)д�����NaHCO3�ᾧ���ܷ�Ӧ����ʽ��________��
(2)Aƿ�ϵķ�Һ©������װ���Լ���________(����)��Bƿ����װ���Լ���________(����)��Cƿ����װ���Լ���________(����)��A��B��Cƿ��________ƿҪ���ڱ�ˮ���У�
������
|
����(1)NH3��CO2��H2O��NaCl(����)��NaHCO3��NH4Cl ����(2)��,��,�ۢ�,C |

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����ΪһЩ������Ԫ�ؼ���Ӧ�⻯��е�����ݣ�
Ԫ�� �� �ԡ� �� | ������������ Ԫ �� �� �š����������� | |||||
�� | �� | �� | �� | �� | �� | |
�⻯��ķе㣨�棩 | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
�� �� �� �� �� | +6 | +5 | +5 | +7 | ||
�� �� �� �� �� | -2 | -3 | -2 | -3 | -1 | -1 |
������A��B��Y��Ϊ�ϱ��е�Ԫ�ء�X��һ����ʷ�ƾã�Ӧ�ù㷺�Ľ���Ԫ�ء�
�� X��Y���γɻ�����XY��XY2, ���߿��ýӴ�����ǿ��ף�
�� A��B���γɻ�����AB��AB2�����߾��������Ʊ�ǿ���ҡ�
��ش�
��1��Ԫ�� �� �⻯��ķ���ʽ�� __________��
��2�������й�ǿ��ס���˵����ȷ���� ________��
a�� ���ߵ�Ũ��Һ�ڳ���ʱ���������ƻ����Ƶ���������
b�� ���ߵ�Ũ��Һ�ڳ��������з��ã���������仯
c�� ��ҵ����ǿ��ס���ʱ����Ҫ��ˮ������Ӧ��������
d�� ���ߵ�ϡ��Һ����ǿ������
��3����ҵ����ǿ���ʱ����Ũ��ˮ����β���������ij����Ρ�
��ѧ����ʽΪ__________________________________��
��4��д����ҵ����ǿ����ʱ���AB�Ļ�ѧ����ʽ������������������������������ ��
��5����ҵ����ǿ����ʱ���ô�����Һ����β�����÷�Ӧ���£�
AB + AB2 + Na2CO3 = 2 ��![]() ��+ CO2
��+ CO2
�� �ڷ�������ij�ε���ѧʽ
�� ÿ����44.8 L����״����CO2��������β���������� ______�硣
��6�� �������ڵ������ڵ�Ԫ����_______________���ñ���Ԫ�ر����д����