题目内容
亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4·FeSO4·6H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
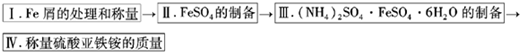
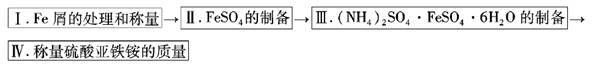
如图为制取摩尔盐的简要流程:

请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是 。
(2)步骤②中的操作是加热蒸发、 、 。为什么不能加热蒸干? 。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的 试纸、稀盐酸和 溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和 ,预期的现象和结论是 。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为 。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4. 0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL
①本实验的指示剂是 (填字母)。
A.酚酞 B.石蕊 C.甲基橙 D.不需要
②KMnO4溶液置于_ (填“酸式”或“碱式”)滴定管中·
③滴定终点的现象是___ 。
④产品中Fe2+的百分含量是___ 。
(1)防止Fe2+被氧化(1分)
(2)冷却结晶;过滤;摩尔盐受热易分解易被氧化(各1分)
(3)①红色石蕊;氢氧化钡(各1分)
②氯水(或双氧水)(1分);加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+(2分)
③继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+(1分)
(4)①D(1分)
②酸式(1分)
③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色(2分)
④14%(2分)
【解析】
试题分析:(1)尽量避免摇晃或搅拌,防止Fe2+被氧化。
(2)还需要冷却结晶、过滤;摩尔盐受热易分解易被氧化。
(3)根据题意①红色石蕊;氢氧化钡;②氯水(或双氧水),加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+;③继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+。
(4)①KMnO4溶液本身有色,不需要指示剂。
②酸性、氧化性试剂应该选择酸式滴定管。
③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色。
④根据电子守恒KMnO4~5 Fe2+,所以n(Fe2+)=5×10×10-3 L×0.20mol/L=10-2 mol, Fe2+的百分含量为10-2 mol×56g/mol÷4.0g×100%=14%。
考点:考察元素及其化合物性质、化学实验知识、化学反应的计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
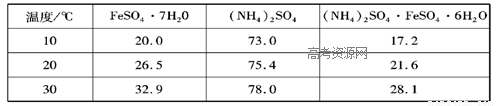
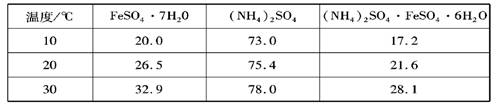
小学生10分钟应用题系列答案| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)