题目内容
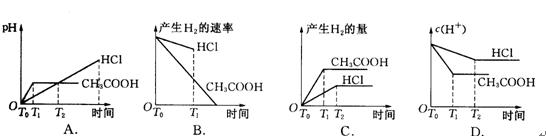
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是( )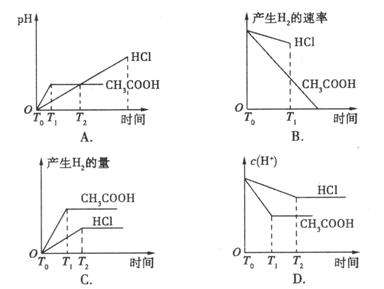
C
【解析】 1 LpH=2的盐酸和醋酸,n(HCl)=0.01 mol,n(CH3COOH)>0.01 mol。若0.65 g锌与0.01 mol HCI反应,则锌过量;但对于醋酸,由于随着反应的进行,继续电离,使n(H+)>0.01 mol,过量的锌将继续反应放出氢气。因此,反应的速率为醋酸快,生成的氢气为醋酸多,观察图线得C为正确选项。

练习册系列答案
相关题目
 CH3OH
( g ) △H=-116kJ/mol
CH3OH
( g ) △H=-116kJ/mol
 CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0 