题目内容
【题目】有五种元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。![]() 元素为主族元素,
元素为主族元素,![]() 原子的
原子的![]() 层上有两个未成对电子且无空轨道;
层上有两个未成对电子且无空轨道;![]() 原子的价电子排布式为
原子的价电子排布式为![]() ;Z原子的
;Z原子的![]() 电子层的
电子层的![]() 亚层上有一个空轨道;
亚层上有一个空轨道;![]() 原子的
原子的![]() 电子层的
电子层的![]() 亚层上只有一对成对电子;
亚层上只有一对成对电子;![]() 原子的
原子的![]() 电子层上
电子层上![]() 轨道半充满。下列叙述不正确的是( )
轨道半充满。下列叙述不正确的是( )
A.元素![]() 和
和![]() 可形成化合物
可形成化合物![]()
B. ![]() 与
与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C. ![]() 和
和![]() 结合生成的化合物为离子化合物
结合生成的化合物为离子化合物
D.![]() 是由极性键构成的非极性分子
是由极性键构成的非极性分子
【答案】C
【解析】
X原子的M层上有两个未成对电子且无空轨迹,核外电子排布为1s22s22p63s23p4,故X为S元素;Y原子的价电子排布式为3d64s2,则Y为Fe;Z原子的L电子层的p亚层上有一个空轨道,核外电子排布为1s22s22p2,则Z为C元素;Q原子的L电子层的p亚层上有一对成对电子,核外电子排布为1s22s22p4,则Q为O元素;T原子的M电子层上p轨道半充满,核外电子排布为1s22s22p63s23p3,则T为P元素。
A.Fe元素和O元素可形成化合物Fe2O3,故A正确;
B.![]() 的最高价氧化物对应的水化物为硫酸,
的最高价氧化物对应的水化物为硫酸,![]() 的最高价氧化物对应的水化物为磷酸,硫酸的酸性比磷酸强,故B正确;
的最高价氧化物对应的水化物为磷酸,硫酸的酸性比磷酸强,故B正确;
C.X和Q结合生成的化合物为二氧化硫、三氧化硫,均为共价化合物,故C错误;
D.CO2中碳氧原子间为极性键,为直线型结构,分子中正负电荷重心重合,属于非极性分子,故D正确;
综上所述,答案为C。

练习册系列答案
相关题目
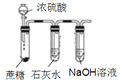
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D