题目内容
(2010?西城区模拟)有机物A是合成解热镇痛药阿司匹林( )和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料
)和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料 .
.
(1)实验室用A和乙酸酐[化学式为(CH3CO)2O]反应合成阿司匹林.
①由A合成阿司匹林反应的化学方程式是
 .
.
②反应结束时,可用于检验A是否转化完全的试剂是
(2)由A合成奥沙拉嗪钠的路线如图所示:
①C含有的官能团名称是
②D可能发生反应的反应类型是
a.取代反应;b.加成反应;c.消去反应;d.氧化反应
③E的分子结构对称,其核磁共振氢谱具有5个吸收峰,则奥沙拉嗪钠的结构简式是
 .
.
④符合下列条件的B的同分异构体J有
a.J分子内苯环上有2个取代基,且能发生水解反应和银镜反应;b.1mol J与足量的Na反应生成0.5mol H2.
 )和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料
)和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料 .
.(1)实验室用A和乙酸酐[化学式为(CH3CO)2O]反应合成阿司匹林.
①由A合成阿司匹林反应的化学方程式是


②反应结束时,可用于检验A是否转化完全的试剂是
饱和溴水或FeCl3溶液
饱和溴水或FeCl3溶液
;可用于检测产物阿司匹林含有的官能团的物理方法是测其红外光谱
测其红外光谱
.(2)由A合成奥沙拉嗪钠的路线如图所示:
①C含有的官能团名称是
羟基、酯基和硝基
羟基、酯基和硝基
.②D可能发生反应的反应类型是
abd
abd
.a.取代反应;b.加成反应;c.消去反应;d.氧化反应
③E的分子结构对称,其核磁共振氢谱具有5个吸收峰,则奥沙拉嗪钠的结构简式是


④符合下列条件的B的同分异构体J有
6
6
种.a.J分子内苯环上有2个取代基,且能发生水解反应和银镜反应;b.1mol J与足量的Na反应生成0.5mol H2.
分析:实验室用A和乙酸酐[化学式为(CH3CO)2O]发生取代反应合成阿司匹林,A中羟基上氢原子被CH3CO-取代生成乙酰水杨酸,所以A是邻羟基苯甲酸,A和甲醇发生酯化反应生成邻羟基苯甲酸甲酯,邻羟基苯甲酸甲酯和硝酸发生取代反应生成含有硝基、酚羟基和酯基的C,C和铁、HCl发生取代反应生成D,F中的硝基被氨基取代生成含有氨基、硝基和酚羟基的D,D和亚硝酸钠、HCl、B反应生成E,根据提供信息知,苯环上酚羟基对位的氢原子被取代,所以D的结构简式为: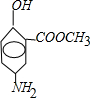 ,C的结构简式为
,C的结构简式为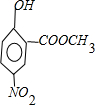 ,B的结构简式为
,B的结构简式为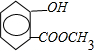 ,E的结构简式为:
,E的结构简式为: .
.
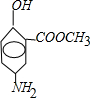 ,C的结构简式为
,C的结构简式为 ,B的结构简式为
,B的结构简式为 ,E的结构简式为:
,E的结构简式为: .
.解答:解:实验室用A和乙酸酐[化学式为(CH3CO)2O]发生取代反应合成阿司匹林,A中羟基上氢原子被CH3CO-取代生成乙酰水杨酸,所以A是邻羟基苯甲酸,A和甲醇发生酯化反应生成邻羟基苯甲酸甲酯,邻羟基苯甲酸甲酯和硝酸发生取代反应生成含有硝基、酚羟基和酯基的C,C和铁、HCl发生取代反应生成D,F中的硝基被氨基取代生成含有氨基、硝基和酚羟基的D,D和亚硝酸钠、HCl、B反应生成E,根据提供信息知,苯环上酚羟基对位的氢原子被取代,所以D的结构简式为: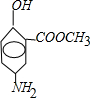 ,C的结构简式为
,C的结构简式为 ,B的结构简式为
,B的结构简式为 ,E的结构简式为:
,E的结构简式为: .
.
(1)①通过以上分析知,邻羟基苯甲酸和乙酸酐反应方程式为:
 ,故答案为:
,故答案为: ;
;
②邻羟基苯甲酸和阿司匹林结构的不同是,邻羟基苯甲酸含有酚羟基,阿司匹林含有酯基,可以用饱和溴水或氯化铁溶液检验,如果溶液中出现白色沉淀或溶液呈紫色,则说明邻羟基苯甲酸反应不完全,用于检测产物阿司匹林含有的官能团的物理方法是测其红外光谱,故答案为:饱和溴水或FeCl3溶液;测其红外光谱;
(2)①通过以上分析知,C含有的官能团名称为:羟基、酯基和硝基,故答案为:羟基、酯基和硝基;
②D的结构中含有酚羟基、酯基、苯环和氨基,所以能发生取代反应、加成反应、水解反应和氧化反应,但不能发生消去反应,故选abd;
③通过以上分析知,E的结构简式为:
 ,故答案为:
,故答案为: ;
;
④a.J分子内苯环上有2个取代基,且能发生水解反应和银镜反应,说明含有酯基和醛基;b.1mol J与足量的Na反应生成0.5mol H2,说明含有一个羟基或羧基,所以该有机物的结构简式可能为 及其两种结构邻位、间位和对位共6种同分异构体,故答案为:6.
及其两种结构邻位、间位和对位共6种同分异构体,故答案为:6.
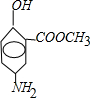 ,C的结构简式为
,C的结构简式为 ,B的结构简式为
,B的结构简式为 ,E的结构简式为:
,E的结构简式为: .
.(1)①通过以上分析知,邻羟基苯甲酸和乙酸酐反应方程式为:
 ,故答案为:
,故答案为: ;
;②邻羟基苯甲酸和阿司匹林结构的不同是,邻羟基苯甲酸含有酚羟基,阿司匹林含有酯基,可以用饱和溴水或氯化铁溶液检验,如果溶液中出现白色沉淀或溶液呈紫色,则说明邻羟基苯甲酸反应不完全,用于检测产物阿司匹林含有的官能团的物理方法是测其红外光谱,故答案为:饱和溴水或FeCl3溶液;测其红外光谱;
(2)①通过以上分析知,C含有的官能团名称为:羟基、酯基和硝基,故答案为:羟基、酯基和硝基;
②D的结构中含有酚羟基、酯基、苯环和氨基,所以能发生取代反应、加成反应、水解反应和氧化反应,但不能发生消去反应,故选abd;
③通过以上分析知,E的结构简式为:
 ,故答案为:
,故答案为: ;
;④a.J分子内苯环上有2个取代基,且能发生水解反应和银镜反应,说明含有酯基和醛基;b.1mol J与足量的Na反应生成0.5mol H2,说明含有一个羟基或羧基,所以该有机物的结构简式可能为
 及其两种结构邻位、间位和对位共6种同分异构体,故答案为:6.
及其两种结构邻位、间位和对位共6种同分异构体,故答案为:6.点评:本题考查有机推断与合成,是对有机化合物知识的综合考查,利用给出的反应信息是解题的关键,能较好的考查考生的阅读、自学能力和思维能力,是高考热点题型,难度中等.

练习册系列答案
相关题目
 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
