��Ŀ����
��2013?����ģ�⣩��18gͭ�����Ļ����Ͷ��200mLϡ�����У���ַ�Ӧ��õ���״����2.24LNO��ʣ��9.6g��������������200mL��Ũ�ȵ�ϡ���ᣬ������ȫ�ܽ⣬�ֵõ���״����2.24LNO������Ӧ�����Һ�м���KSCN��Һ����Һ����죬������˵����ȷ���ǣ�������
��������Һ����죬����Ӧ��ǡ����ȫ��Ӧ����û�����������ӣ�Ҳû������ʣ�࣮���Կ�����18g���������400ml���ᷴӦ����0.2mol NO����ͭȫ�����ɶ��۵����ӣ��������ӷ�Ӧ��ʵ�ʽ��з������㣮
����⣺��Һ����죬����Ӧ��ǡ����ȫ��Ӧ����û�����������ӣ�Ҳû������ʣ�࣮���Կ�����18g���������400ml���ᷴӦ����0.2mol NO����ͭȫ�����ɶ��۵����ӣ�����ΪA mol��ͭΪBmol�������ķ�Ӧ���ӷ���ʽΪ��3Fe+8H++2NO3-=3Fe2++2NO��+4H2O��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O�����������̣�
56A+64B=18��2A/3+2B/3=0.2��
��ã�A=0.15mol��B=0.15mol ����õ�18g������к�������Ϊ0.15mol��56g/mol=8.4g��
��ͭ����Ϊ0.15mol��64g/mol=9.6g��
A��ԭ�������ͭ������0.15mol����A��ȷ��
B������Ũ��Ϊ��C��HNO3��=0.8mol/0.4L=2mol/L��ϡ��������ʵ���Ũ��Ϊ2mol/L����B����
C����һ��ʣ�����9.6g��ͨ����������õ�Ϊͭ����C����
D����Һ�ж���������Ϊ0.15mol�������ټ������NOΪ0.05mol��11.2L����D����
��ѡA��
56A+64B=18��2A/3+2B/3=0.2��
��ã�A=0.15mol��B=0.15mol ����õ�18g������к�������Ϊ0.15mol��56g/mol=8.4g��
��ͭ����Ϊ0.15mol��64g/mol=9.6g��
A��ԭ�������ͭ������0.15mol����A��ȷ��
B������Ũ��Ϊ��C��HNO3��=0.8mol/0.4L=2mol/L��ϡ��������ʵ���Ũ��Ϊ2mol/L����B����
C����һ��ʣ�����9.6g��ͨ����������õ�Ϊͭ����C����
D����Һ�ж���������Ϊ0.15mol�������ټ������NOΪ0.05mol��11.2L����D����
��ѡA��
���������⿼�����������������ͭ�����������ʵ�Ӧ�ã���Ҫ�Ƿ�Ӧ���̵ļ���Ӧ�ã����ݷ�Ӧ��������ļ����ж��ǽ���ؼ���

��ϰ��ϵ�д�
�����Ŀ
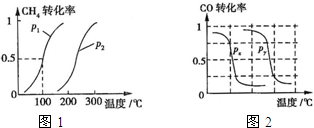 ��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״���
��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״���


