��Ŀ����
����Ŀ��ij�о�С��Ϊ��̽�������������Ӧ�����������˼���ʵ�顣����д���пհף�
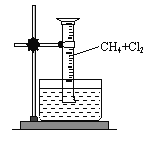
��ʵ��һ������ͼ��ʾװ�ã��ռ�һ�Թܼ���������Ļ�����壬�պ�۲쵽��Ͳ���γ�һ��ˮ������Ϊ���Ȼ������ɡ�
��1���÷�Ӧ�ķ�Ӧ����Ϊ
��2���÷�Ӧ�Ļ�ѧ����ʽΪ��ֻд��һ���� ��
��3��ˮ����ʢ�ŵ�Һ��ӦΪ �������ţ�
A��ˮ B������ʯ��ˮ C������ʳ��ˮ D������NaHCO3��Һ
��ʵ������ռ�һ�Թܼ���������Ļ�����壬���շ�Ӧ�μ�AgNO3��Һ�������а�ɫ�������ɣ���Ϊ���Ȼ������ɡ�
��4������Ϊ��ʵ����Ƶó��Ľ����Ƿ���ȷ�� ��
������ȷ�������ǣ�
��ʵ������
����һ���ռ����Թ�����������10 mL����ˮ�����������DISϵͳ��pH����������Һ��pH����ͬ�������pH = 3.26
��������ռ�һ�Թܼ���������Ļ�����壨��ռ50%������40 W���չ���¹���6 min����10 mL����ˮ����������pH = 1.00��
��5���жϸ÷�Ӧ�����Ȼ������ɵ�������
���𰸡���1��ȡ����Ӧ��2��CH4+Cl2![]() CH3Cl+HCl��3��C
CH3Cl+HCl��3��C
��4������ȷ ��ˮ�м�������Ҳ���������
��5���������õ�pH�Ȳ���һ���PHС
��������
�����������1���ڹ��յ������£������ͼ����ܷ���ȡ����Ӧ��
��2�������������ڹ����·���ȡ����Ӧ����������е���ԭ�ӱ����������е���ԭ��ȡ��������һ�ȼ�����Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪCH4+Cl2![]() CH3Cl+HCl��
CH3Cl+HCl��
��3��Ϊ��ֹ�������ܽ�����٣�ˮ����ʢ�ŵ�Һ�����Ϊ����ʳ��ˮ��BD���ܺ�������Ӧ����ѡC��
��4����ˮ�д��ڻ�ѧƽ�⣺Cl2+H2O ![]() H+ + Cl- + HClO�����Ե���ˮ�м���AgNO3��ҺʱҲ�ᷢ����ӦAg++Cl-=AgCl����������ɫ���������Եó��Ľ��۲���ȷ��
H+ + Cl- + HClO�����Ե���ˮ�м���AgNO3��ҺʱҲ�ᷢ����ӦAg++Cl-=AgCl����������ɫ���������Եó��Ľ��۲���ȷ��
��4������һ����������ˮ��Cl2+H2O![]() H++Cl-+HClO�������ᣬ��pHΪ3.26���������pH=1.00����3.26С��˵��������������ˮ����������б�ķ�Ӧ����HCl�����Դ�Ϊ�������õ�pHֵ�Ȳ���һ��õ�pHֵ�͡�
H++Cl-+HClO�������ᣬ��pHΪ3.26���������pH=1.00����3.26С��˵��������������ˮ����������б�ķ�Ӧ����HCl�����Դ�Ϊ�������õ�pHֵ�Ȳ���һ��õ�pHֵ�͡�

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д�