题目内容
已知X、Y、Z、W、Q均为含氮化合物,它们在一定条件下有如下转换关系(未配平):
(1)X→W+O2
(2)Z+Y+NaOH→H2O+W
(3)Y+SO2→Z+SO3
(4)Q+Y→Z+H2O
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO
则这五种含氮化合物中氮元素的化合价由高到低的顺序为:
A.X>Y>Z>W>Q
B.X>Z>Y>Q>W
C.X>Y>W>Z>Q
D.W>X>Z>Q>Y.
(1)X→W+O2
(2)Z+Y+NaOH→H2O+W
(3)Y+SO2→Z+SO3
(4)Q+Y→Z+H2O
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO
2- 4 |
则这五种含氮化合物中氮元素的化合价由高到低的顺序为:
C
C
A.X>Y>Z>W>Q
B.X>Z>Y>Q>W
C.X>Y>W>Z>Q
D.W>X>Z>Q>Y.
分析:在氧化还原反应中,得电子的元素化合价降低,失电子的元素化合价升高,据此判断.
解答:解:(1)X→W+O2中,X中氧元素失电子化合价升高,则N元素得电子化合价降低,所以N元素化合价X>W;
(3)Y+SO2→Z+SO3中,S元素失电子,则Y中N元素得电子,所以N元素化合价Y>Z;
(2)Z+Y+NaOH→H2O+W中,Y和Z发生氧化还原反应,则N元素化合价,W处于Z和Y中间,根据(2)知,N元素化合价Y>W>Z;
(4)Q+Y→Z+H2O中,N元素化合价,Z处于Q和Y之间,根据(3)知,Y>Z,所以Z>Q;
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO4 2-,铜元素失电子,则X得电子生成Y,所以N元素化合价,X>Y;
所以这五种含氮化合物中氮元素的化合价由高到低的顺序为:X>Y>W>Z>Q,故选C.
(3)Y+SO2→Z+SO3中,S元素失电子,则Y中N元素得电子,所以N元素化合价Y>Z;
(2)Z+Y+NaOH→H2O+W中,Y和Z发生氧化还原反应,则N元素化合价,W处于Z和Y中间,根据(2)知,N元素化合价Y>W>Z;
(4)Q+Y→Z+H2O中,N元素化合价,Z处于Q和Y之间,根据(3)知,Y>Z,所以Z>Q;
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO4 2-,铜元素失电子,则X得电子生成Y,所以N元素化合价,X>Y;
所以这五种含氮化合物中氮元素的化合价由高到低的顺序为:X>Y>W>Z>Q,故选C.
点评:本题考查化合价高低判断,根据得失电子与元素化合价的关系来分析解答即可,难度不大.

练习册系列答案
相关题目
 已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是( )
已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是( )


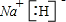
 、
、 、
、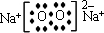
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )