题目内容
某光卤石(KCl·MgCl2·6H2O)样品中含有不与NaOH溶液和盐酸反应的可溶性杂质。有多种实验方案可测定样品中KCl·MgCl2·6H2O的质量分数,请根据下列所提供的实验试剂和仪器(仪器可根据需要任意选择),选择精确度较好的实验方案,完成实验步骤中第二步及以后的实验步骤和实验结果。(1)可供选用的试剂;
①a mol·L-1 NaOH溶液 ②b mol·L-1Na2CO3溶液 ③c mol·L-1盐酸 ④d mol·L-1 AgNO3溶液 ⑤甲基橙 ⑥酚酞
(2)实验步骤
第一步:称取m g样品,放入250 mL烧杯中,加适量水溶解;
第二步:_______________________________________________________;
第三步:_______________________________________________________;
第四步:_______________________________________________________。
(3)计算样品中KCl·MgCl2·6H2O质量分数的表达式____________________。
解析:要测定KCl·MgCl2·6H2O的质量分数,从提供的试剂看,可采用下列途径:①选用NaOH溶液,有关系式2OH-![]() Mg2+
Mg2+![]() Mg(OH)2
Mg(OH)2![]() KCl·MgCl2·6H2O;②选用Na2CO3溶液,有关系式
KCl·MgCl2·6H2O;②选用Na2CO3溶液,有关系式![]()
![]() Mg2+
Mg2+![]() MgCO3
MgCO3![]() KCl·MgCl2·6H2O;③选用AgNO3溶液有关系式Ag+
KCl·MgCl2·6H2O;③选用AgNO3溶液有关系式Ag+![]() Cl-
Cl-![]() AgCl
AgCl![]()
![]() KCl·MgCl2·6H2O。实验可测加入试剂的量,也可测生成沉淀的量,测沉淀的量,步骤多误差大,测加入试剂的量,可用滴定法,操作简单,精确度高。
KCl·MgCl2·6H2O。实验可测加入试剂的量,也可测生成沉淀的量,测沉淀的量,步骤多误差大,测加入试剂的量,可用滴定法,操作简单,精确度高。
答案:第二步:加入A mL a mol·L-1 NaOH溶液(过量)充分反应过滤
第三步:在滤液中加入2—3滴酚酞试液,溶液显浅红色
第四步:用c mol ·L-1盐酸滴定上述溶液由浅变为无色为止,测得消耗盐酸B mL
w(KCl·MgCl2·6H2O)=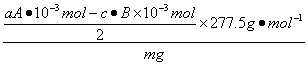 ×100%
×100%

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案(10分)江苏省拥有丰富的海洋资源,盐化工是连云港市的主要产业之一。从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl。
![]() 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
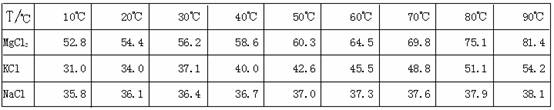 |
![]()
![]()
![]()
![]()
![]()
并设计出下面的实验流程:w.w.w.k.s.5.u.c.o.m
![]()

![]()
![]()
![]()
![]()
根据他们提供的数据和实验回答下列问题:
![]() 问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
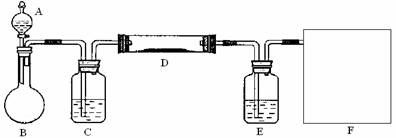
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
问题3:MgO则是重要的耐火材料。在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2?6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则 a∶b≈_______(取整数值)。