题目内容
某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液和盐酸反应的杂质,某校化学课外活动研究小组现欲测定此样品中含KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案。
请根据提供的实验试剂和仪器(所需的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
一、可选用的实验试剂:
(1)![]() mol·L
mol·L![]() NaOH溶液 (2)
NaOH溶液 (2)![]() mol·L
mol·L![]() Na2CO3溶液 (3)c mol·L
Na2CO3溶液 (3)c mol·L![]() HCl溶液
HCl溶液
(4)d mol·L![]() AgNO3溶液 (5)酚酞试液 (6)甲基橙试液
AgNO3溶液 (5)酚酞试液 (6)甲基橙试液
二、实验步骤:
第一步:称取m g样品,放入250mL烧杯中,加适量水溶解
第二步:
计算样品中含KCl·MgCl2·6H2O(相对分子质量为277.5)的质量分数的表达式:
。
第二步:加入A mL ![]() mol·L
mol·L![]() NaOH溶液(过量),充分反应;第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴;第四步:用c mol·L
NaOH溶液(过量),充分反应;第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴;第四步:用c mol·L![]() HCl溶液滴定至由浅红色变为无色且在半分钟内不再变色,消耗HCl溶液B mL.
HCl溶液滴定至由浅红色变为无色且在半分钟内不再变色,消耗HCl溶液B mL.
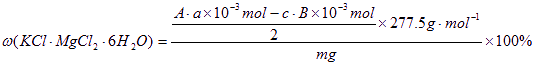
解析:
1.实验原理:根据KCl·MgCl2·6H2O的性质,可加入足量的NaOH溶液,再从所加试剂的量入手,或可用生成沉淀的质量进行计算来求得. 2.由实验操作的难易确定最佳途径:①测定沉淀的质量:需要过滤、洗涤、烘干,步骤多,误差较大;②测定所加试剂的量:可通过滴定法,精确度较高,操作较简便.由此可见,方法②为最佳途径. 3.再由细节,求完善:(1)为了使沉淀完全,沉淀剂必须过量;过量的试剂必须准确测出,涉及的实验步骤要尽可能少. (2)中和滴定中指示剂的选择也很关键,仅仅从中和反应本身来讲,甲基橙、酚酞皆可用,但在此实验中影响到实验操作的难易,如选甲基橙作滴定过量碱的指示剂,就必须对生成的Mg(OH)2沉淀进行过滤、洗涤且将洗涤液合并后,再进行滴定;如选酚酞试液作指示剂,Mg(OH)2沉淀就无需过滤,因为酚酞变色范围在pH=8~10,滴定到终点时Mg(OH)2沉淀不会溶解.显然,用酚酞作指示剂简化了实验步骤,提高了实验的精确度,所以应选用酚酞作为测定过量的NaOH的指示剂。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案(10分)江苏省拥有丰富的海洋资源,盐化工是连云港市的主要产业之一。从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl。
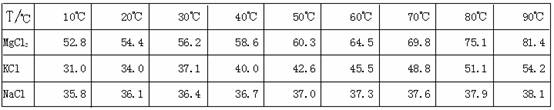
![]() 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
 |
![]()
![]()
![]()
![]()
![]()
并设计出下面的实验流程:w.w.w.k.s.5.u.c.o.m
![]()

![]()
![]()
![]()
![]()
根据他们提供的数据和实验回答下列问题:
![]() 问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
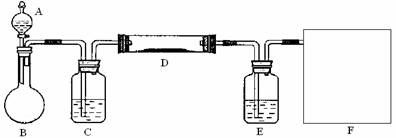
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
问题3:MgO则是重要的耐火材料。在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2?6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则 a∶b≈_______(取整数值)。