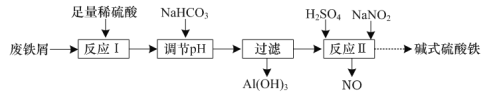
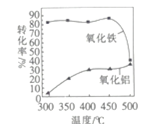
题目内容
【题目】某化学反应:3A(g)![]() 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
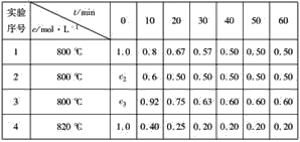
根据上述数据,完成下列填空:
(1)c2=______ mol·L-1。
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为_______________,理由是__________________________
(3)求在实验4中,反应在0~10 min内反应物A的平均反应速率为______________。
【答案】1.0 实验2 达平衡时2组的时间较短,所以只能是加入催化剂 0.06mol/(Lmin)
【解析】
(1)根据实验1、2数据、利用影响速率的因素来分析;
(2)根据催化剂能加快化学反应,续短到达平衡的时间,平衡不移动;
(3)根据V=![]() 及表格中的数据来计算反应速率;
及表格中的数据来计算反应速率;
(1)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0molL-1,
故答案为:1.0;
(2)温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,
故答案为:实验2;达平衡时2组的时间较短,所以只能是加入催化剂;
(3)v(A)=![]() =
=![]() =0.06mol/(Lmin),
=0.06mol/(Lmin),
故答案为:0.06mol/(Lmin)。

【题目】甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示。
化学反应 | 化学平衡常数 | 温度(℃) | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
(1)下列措施能使反应③的平衡体系中![]() 增大的是__
增大的是__
A.将H2O(g)从体系中分离出去 B.恒容时充入He(g),使体系压强增大
C.升高温度 D.恒容时再充入1molH2(g)
(2)T℃时,反应③在恒容密闭容器中充入1molCO2和nmolH2,混合气体中CH3OH的体积分数与氢气的物质的量的关系如图1所示。图1中A、B、C三点对应的体系,CO2的转化率最大的是___(填字母)。
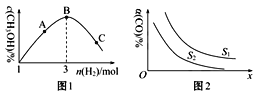
(3)工业上也用合成气(H2和CO)合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是___。
②300℃时,氢气的物质的量随时间变化如表所示
反应时间/min | 0 | 1 | 4 | 5 |
H2/mol | 8 | 5.4 | 4 | 4 |
在该温度下,上述反应的平衡常数为___。若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH,保持温度和容器体积不变,则平衡会___(填“正向移动”“逆向移动”或“不移动”)。