题目内容
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)画出⑥的离子结构示意图__________。
(2)在②、③、④、⑤四种元素中,其简单离子半径按由大到小的排列顺序为______(示例:用r(A2-)>r(B-)的形式表示)。
(3)元素②、③氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,写出该物质的电子式___________________________。
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式____________________________。
(6)比较①与其同族短周期元素的氢化物的熔沸点高低,并说明理由_____________。
【答案】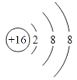 r(O2-)>r(F-)>r(Na+)>r(Al3+)HF>H2O
r(O2-)>r(F-)>r(Na+)>r(Al3+)HF>H2O![]() Al2Al+2OH–+2H2O=2AlO2–+3H2↑NH3>PH3;两者都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高
Al2Al+2OH–+2H2O=2AlO2–+3H2↑NH3>PH3;两者都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高
【解析】
根据元素①~⑧在元素周期表中的位置可知分别是N、O、F、Na、Al、S、Ar、K。则
(1)硫离子的结构示意图为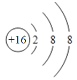 ;
;
(2)②、③、④、⑤四种元素中,其简单离子具有相同的核外电子排布,离子半径随原子序数的增大而减小,则离子半径按由大到小的排列顺序为r(O2-)>r(F-)>r(Na+)>r(Al3+);
(3)同周期自左向右非金属性逐渐增强,氢化物稳定性逐渐增强,因此元素②、③氢化物的稳定性由强到弱的顺序为HF>H2O;
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,该元素是Cl,含氧酸是次氯酸,其电子式为![]() ;
;
(5)氢氧化铝是两性氢氧化物,则表中能形成两性氢氧化物的元素是Al,该元素的单质与⑧的最高价氧化物的水化物氢氧化钾反应的离子方程式为2Al+2OH–+2H2O=2AlO2–+3H2↑;
(6)NH3、PH3都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1. 77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________,溶液中![]() ___________。
___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。



