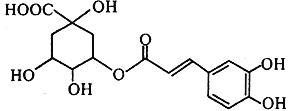
题目内容
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
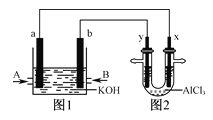
A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
D.电解池中Cl-向x极移动
【答案】C
【解析】
试题解析: 甲烷和O2构成的燃料电池,为原电池,甲烷在负极发生氧化反应,由于观察到x电极附近出现白色沉淀。说明产生氢氧化铝沉淀,x电极为电解池的阴极,A为原电池的负极,发生氧化反应:甲烷失电子,被氧化;C正确;答案B应生成氢氧化铝沉淀,错误;图1中甲烷的燃料电池不断消耗碱,溶液的pH减少;A错误;D.电解池中Cl-向阳极移动,x极为阴极;D错误;
考点:电化学知识的考察;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D. 该温度下此反应的平衡常数:K=1.44