题目内容
某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验。(夹持装置已略去)
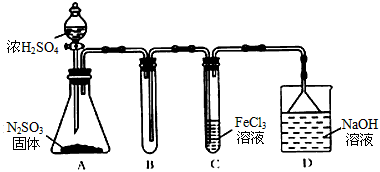
(1)在配制氯化铁溶液时需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是______________________,操作中不需要的仪器有____(填入正确选项前的字母);
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C装置中观察到的现象为____________________
(3)根据以上现象,该小组同学认为SO2与Fe3+反应生成SO42-和Fe2+。
①写出SO2与Fe3+反应的离子方程式________________________;
②请设计实验方案检验C试管中生成的Fe2+:________________________
③该小组向C装置反应后的溶液中加入稀硝酸酸化的BaCl2溶液,出现白色沉淀,证明反应生成了SO42-,该做法______(填“合理”或“不合理”),理由是__________________
(4)D装置中倒置漏斗的作用是___________________
(5)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂是_________(填字母)
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.Na2S溶液
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C装置中观察到的现象为____________________
(3)根据以上现象,该小组同学认为SO2与Fe3+反应生成SO42-和Fe2+。
①写出SO2与Fe3+反应的离子方程式________________________;
②请设计实验方案检验C试管中生成的Fe2+:________________________
③该小组向C装置反应后的溶液中加入稀硝酸酸化的BaCl2溶液,出现白色沉淀,证明反应生成了SO42-,该做法______(填“合理”或“不合理”),理由是__________________
(4)D装置中倒置漏斗的作用是___________________
(5)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂是_________(填字母)
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.Na2S溶液
(1)浓盐酸;抑制氯化铁水解;ce
(2)溶液由棕黄色变为浅绿色
(3)①2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;②取装置C中反应后的溶液,向其中滴入KSCN溶液,不变 红,再加新制氯水,溶液变红(合理即可);③不合理;硝酸可以将溶解的SO2氧化为H2SO4,干扰实验 (4)使气体充分吸收、防止溶液倒吸
(5)bc
(2)溶液由棕黄色变为浅绿色
(3)①2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;②取装置C中反应后的溶液,向其中滴入KSCN溶液,不变 红,再加新制氯水,溶液变红(合理即可);③不合理;硝酸可以将溶解的SO2氧化为H2SO4,干扰实验 (4)使气体充分吸收、防止溶液倒吸
(5)bc

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
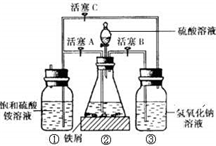 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
