��Ŀ����
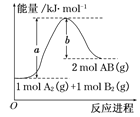
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ�����������ʷ����ĵ缫��Ӧ����д������ش��������⣺
��1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
��д����ⱥ��NaCl��Һ�ܵ����ӷ���ʽ_____��
����X�������۲쵽��������_____������Y�缫��Ӧ����ķ�����_____��
��2����Ҫ�õ�ⷽ��������ͭ������п��������Ͳ��������ʣ������Һaѡ��CuSO4��Һ����
��X�缫�����ķ�Ӧ����Ϊ_____�����ӵ�������_____��_____����X��Y������Y�缫�IJ�����_____���缫��ӦʽΪ_____��CuSO4��Һ��Ũ��_____������䡱���������ӡ������м��١�����

���𰸡�2Cl��+2H2O![]() 2OH��+H2��+Cl2���ų����壬��Һ����ʪ��ĵ⻯�ص�����ֽ����Y�缫��������ֽ����ɫ��ԭ��ӦY��X��ͭCu��2e��=Cu2+ ��Zn��2e��Zn2+�� Fe��2e��Fe2+���м���
2OH��+H2��+Cl2���ų����壬��Һ����ʪ��ĵ⻯�ص�����ֽ����Y�缫��������ֽ����ɫ��ԭ��ӦY��X��ͭCu��2e��=Cu2+ ��Zn��2e��Zn2+�� Fe��2e��Fe2+���м���
��������
��1�����ö��Ե缫��ⱥ��ʳ��ˮʱ��������2Cl����2e��Cl2����������2H+��2e��H2�����ܷ�ӦΪ��2Cl��+2H2O![]() 2OH��+H2��+Cl2�����ʴ�Ϊ��2Cl��+2H2O
2OH��+H2��+Cl2�����ʴ�Ϊ��2Cl��+2H2O![]() 2OH��+H2��+Cl2������X��Ϊ�������缫��ӦΪ��2H+��2e��H2�����缫����������������Ũ����������ǿ�������۲쵽�������Ƿų����壬��Һ��죻Y��Ϊ�������缫��ӦΪ��2Cl����2e��Cl2������������ͨ����ʪ��ĵ⻯�ص�����ֽ�����飬�ʴ�Ϊ���ų����壬��Һ�������ʪ��ĵ⻯�ص�����ֽ����Y�缫��������ֽ����ɫ��
2OH��+H2��+Cl2������X��Ϊ�������缫��ӦΪ��2H+��2e��H2�����缫����������������Ũ����������ǿ�������۲쵽�������Ƿų����壬��Һ��죻Y��Ϊ�������缫��ӦΪ��2Cl����2e��Cl2������������ͨ����ʪ��ĵ⻯�ص�����ֽ�����飬�ʴ�Ϊ���ų����壬��Һ�������ʪ��ĵ⻯�ص�����ֽ����Y�缫��������ֽ����ɫ��
��2�����ڵ���װ������X�����Դ����������Ϊ������������ԭ��Ӧ����������Ϊ���������·����������Ϊ��Y��X���ʴ�Ϊ����ԭ��Ӧ�� Y��X�����ڵ�⾫��ͭ��װ���У���ͭΪ��������ͭΪ������������ӦΪ��Cu��2e��Cu2+������п������ͭ���ã�Ҳ����ŵ磬��Y�����ᷢ����Zn��2e��Zn2+�� Fe��2e��Fe2+����������ֻ��Cu2+��2e��Cu���ɵ�ɿ�֪CuSO4��Һ��Ũ�����м������ʴ�Ϊ��Cu��2e��=Cu2+ ��Zn��2e��Zn2+�� Fe��2e��Fe2+�����м�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�