题目内容
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p63s23p5.
则下列有关比较中,正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p63s23p5.
则下列有关比较中,正确的是( )
分析:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、;③1s22s22p63s23p5是Cl元素,
A、同周期自左而右第一电离能呈增大趋势,注意第VA族元素第一电离能大于其相邻元素的第一电离能;
B、同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C、同一周期元素的非金属性随着原子序数的增大而增强,其最高价含氧酸的酸性逐渐增强;
D.同周期自左而右电负性逐渐增大.
A、同周期自左而右第一电离能呈增大趋势,注意第VA族元素第一电离能大于其相邻元素的第一电离能;
B、同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C、同一周期元素的非金属性随着原子序数的增大而增强,其最高价含氧酸的酸性逐渐增强;
D.同周期自左而右电负性逐渐增大.
解答:解:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、;③1s22s22p63s23p5是Cl元素,
A.第一电离能大小顺序是:③>②>①,故A错误;
B.原子半径大小顺序是②>①>③,故B错误;
C.其最高价含氧酸的酸性大小顺序是③>①>②,其含氧酸的顺序不一定是③>①>②,如次氯酸的酸性小于亚硫酸,故C错误;
D.同周期自左而右电负性逐渐增大,所以电负性大小顺序是:③>①>②,故D正确;
故选D.
A.第一电离能大小顺序是:③>②>①,故A错误;
B.原子半径大小顺序是②>①>③,故B错误;
C.其最高价含氧酸的酸性大小顺序是③>①>②,其含氧酸的顺序不一定是③>①>②,如次氯酸的酸性小于亚硫酸,故C错误;
D.同周期自左而右电负性逐渐增大,所以电负性大小顺序是:③>①>②,故D正确;
故选D.
点评:考查结构与物质关系、核外电子排布规律、元素周期律等,注意同一周期第一电离能的变化趋势和异常现象,为易错点.

练习册系列答案
相关题目
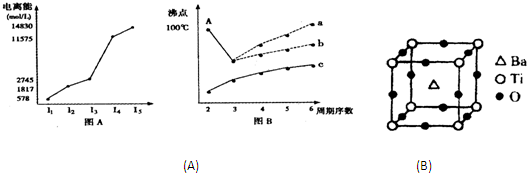
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第