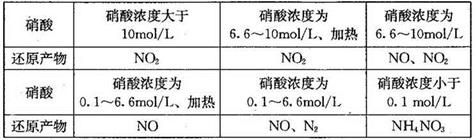
题目内容
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
①恒温恒容下,平衡时NH3的转化率甲 乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)
 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是 。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式: 。反应过程中,氧化剂和还原剂物质的量之比为 。
(2)若反应中生成0.2mol HNO3,转移的电子数目为 。
14分)Ⅰ.(10分)(1)9mL和14.25mL(2分)
(2)①>(1分) ② 1,0.8,1.2(各1分)
(3)D(2分)
(4)c(NO-3)>c(H+)>c(NH+4)>c(OH-)(2分)
Ⅱ . (4分)
(1)3NF3+5H2O=9HF+2NO+HNO3(2分) 2:1 (1分)
(2)2.408×1023 或0.4NA(1分)(写成物质的是不给分)
解析试题分析:I.(1)4NO+3O2+2H2O=4HNO3,剩余气体3mL,过量气体可能是O2或NO,若是O2过量,NO全部参加反应,根据4NO~3O2,V(O2)= 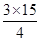 +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=
+3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=  =9mL;
=9mL;
(2)①恒温恒容,乙中投料是甲中投料的4倍,等同于增大压强,平衡逆向移动,因此甲>乙;
②根据等效平衡可知,丙中转化为起始量与甲中的起始量相同,则
4NH3(g)+5O2g)?4NO(g)+6H2O(g),
起始1 2
丙 0.2 x y z
则0.2+y=1, x +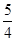 y =2 z =
y =2 z = 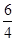 y
y
解得y =0.8,x=1,z=1.2;
(3)恒温恒容下反应相同时间,T1<T2,两个密闭容器中分别充入等量NO2,在T1下,达到平衡时,所用时间为t1,在T2时,在t1时间时已达到平衡,因为升高温度,平衡逆向移动,所以a1>a2,选择时间小于t1,在相同时间内,在T2时,尚未达到平衡,反应正向移动,则有a1小于或等于a2,故答案为:D;
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,得到硝酸铵和硝酸的混合溶液,且二者物质的量相等,二者中都含有NO3-,它浓度最大,NH4+水解,因此C(H+)>C(NH4+),C(OH-)最小,c(NO-3)>c(H+)>c(NH+4)>c(OH-);
Ⅱ.3NF3+5H2O=9HF+2NO+HNO3,NF3既是氧化剂又是还原剂,其中N化合价是+3价,体现氧化性有2mol降到+2价,体现还原性有1mol升到+5价,氧化剂和还原剂物质的量之比为2:1,反应中每有1mol硝酸生成,转移电子2mol,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA。
考点:考查化学反应原理、盐的水解、氧化还原反应、方程式的书写

(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: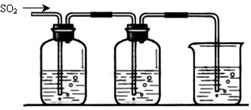
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
F. 坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。
(5)能表明I-的还原性弱于SO2的现象是 。
 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2