题目内容
11.3molA和2.5molB混合于2L密闭容器中,发生的反应如下:3A(g)+B(g)?xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L•min),下列结论不正确的是( )| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 平衡时,A的转化率为20% | |
| C. | 平衡时,C的浓度为0.25mol/L | |
| D. | 容器内的起始压强和平衡压强之比为11:10 |
分析 5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)  C(g)+2D(g)
C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
A.根据v=$\frac{△c}{△t}$计算v(A);
B.A的转化率=$\frac{反应的A的物质的量}{A的起始物质的量}$×100%;
C.根据c=$\frac{n}{V}$计算C的平衡浓度;
D.恒温恒容下,压强之比对物质的量之比.
解答 解:5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)  C(g)+2D(g)
C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
A.v(A)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L•min),故A正确;
B.A的转化率=$\frac{1.5mol}{3mol}$×100%=50%,故B错误;
C.平衡时C的浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故C正确;
D.恒温恒容下,压强之比对物质的量之比,容器内的起始压强和平衡压强之比为(1.5+2+0.5+1)mol:(3+2.5)mol=10:11,故D正确,
故选:B.
点评 本题考查化学平衡的计算,难度不大,关键是确定x的值,注意掌握三段式法在化学平衡计算中应用.

| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
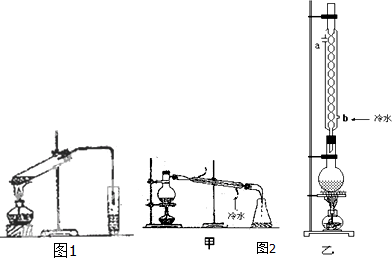
实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(2)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(3)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗.
(4)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?答:乙,反应物能冷凝回流.
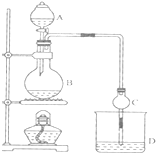 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
| A. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | Ba(NO3)2可溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 试管内壁残留的硫酸铁溶液与氢氧化钠溶液反应后产生红褐色固体,可以用盐酸将其溶解. | |
| D. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L任何气体都含有约6.02×1023个分子 | |
| D. | 在标准状况下1mol H2O的体积约为22.4L |
| A. | 糖类、油脂和蛋白质均可发生水解反应 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
