题目内容
18.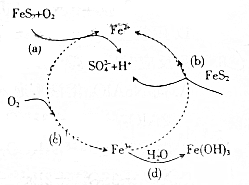 黄铁矿(主要成分为FeS2)是生产硫酸的原料,回答下列问题:
黄铁矿(主要成分为FeS2)是生产硫酸的原料,回答下列问题:黄铁矿在空气中氧化的四步反应模型如图所示.
(1)a,b,c,d四个反应中属于非氧化还原反应的是bd(填字母).
(2)反应a的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3.
(3)反应c的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
分析 (1)反应中存在化合价的变化的反应属于氧化还原反应;
(2)FeS2与氧气在高温下生成氧化铁和二氧化硫;
(3)酸性条件下,亚铁离子被氧气氧化为三价铁离子.
解答 解:(1)a反应中Fe、S、O元素的化合价变化,属于氧化还原反应,b反应中FeS2转化为Fe2+,反应中没有元素化合价的变化,不是氧化还原反应,c反应中Fe、O元素的化合价发生变化,属于氧化还原反应,d反应中没有元素化合价的变化,不是氧化还原反应,
故答案为:bd;
(2)FeS2与氧气在高温下生成氧化铁和二氧化硫,其反应的方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3,故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3;
(3)酸性条件下,亚铁离子被氧气氧化为三价铁离子,其反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
点评 本题考查了氧化还原反应,侧重于氧化还原反应的判断、方程式的书写等内容的考查,注意根据元素化合价的变化分析,题目难度不大.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
6.能证明SO2还原性的是( )
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
13.已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.下列说法或表达正确的是( )
| A. | 在相同的条件下,2 mol氢气与1 mol氧气的总能量小于2 mol水蒸气的总能量 | |
| B. | H2(g)+12O2(g)═H2O(l)△H=-Q1 kJ/mol 则Q1>241.8 | |
| C. | H2(g)+12O2(g)═H2O(l)△H=-Q2 kJ/mol 则Q2<241.8 | |
| D. | 任何条件下,2 L水蒸气分解成2 L氢气与1 L氧气需吸收483.6 kJ热量 |
10.能在水溶液中大量共存的一组离子是( )
| A. | H+、NO3-、Na+、SO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、OH- | D. | Na+、Cl-、H+、SO42- |
7.下列措施合理的是( )
| A. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| B. | 石英容器可盛放任何酸 | |
| C. | 生活中使用明矾净水,除去水中的悬浮的微小颗粒 | |
| D. | 向NaOH溶液中滴加FeCl3溶液制备Fe(OH)3胶体 |
8.下列说法正确的是( )
| A. | 木炭在空气中燃烧发白光、放热 | |
| B. | 氧化反应是指物质与氧气发生的化合反应 | |
| C. | 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧 | |
| D. | 蜡烛燃烧、食物腐败都是氧化反应 |
 $→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+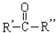
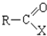 +H2O→R-COOH+HX
+H2O→R-COOH+HX
 、
、 ;
; +nH2O.
+nH2O.