��Ŀ����
19��ij�㶨�¶��£���һ��2L���ܱ������г���A���壬B���壬�����Ũ��Ϊ2mol/L��1mol/L���ҷ������·�Ӧ��3A��g��+2B��g��?4C������+2D����������֪����������C��D״̬δȷ������Ӧһ��ʱ���ﵽƽ�⣬�������1.6molC���ҷ�Ӧǰ��ѹǿ��Ϊ5��4��������˵������ȷ���ǣ��������ٸ÷�Ӧ�Ļ�ѧƽ�����ʽΪ��K=$\frac{{C}^{4}��C��•{C}^{2}��D��}{{C}^{3}��A��•{C}^{2}��B��}$
�ڴ�ʱB��ת����Ϊ35%
���������ϵѹǿ��ƽ�������ƶ�������ѧƽ�ⳣ�����䣮
������C������A��Bת���ʲ��䣮
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ۢ� |
���� ��Ӧһ��ʱ���ﵽƽ�⣬��÷�Ӧǰ��ѹǿ��Ϊ5��4���ʷ�Ӧ�����������С����C��D����һ�ֲ�Ϊ���壻��һ��2L���ܱ������г���A���壬B���壬�����Ũ��Ϊ2mol/L��1mol/L����A���壬B��������ʵ����ֱ�Ϊ2mol/L��2L=4mol��1mol/L��2L=2mol����Ӧǰ�����ܵ����ʵ���Ϊ4mol+2mol=6mol����÷�Ӧǰ��ѹǿ��Ϊ5��4����ƽ��ʱ�����ܵ����ʵ���Ϊ6mol��$\frac{4}{5}$=4.8mol������1.6molC��������D�����ʵ���Ϊ1.6��$\frac{2}{4}$=0.8mol����Ӧ��B�����ʵ���Ϊ1.6��$\frac{2}{4}$=0.8mol����ӦA�����ʵ���Ϊ1.6��$\frac{3}{4}$=1.2mol����ƽ��ʱ��A��B��C��D�����ʵ����ֱ�Ϊ4mol-1.2mol=2.8mol��2mol-0.8mol=1.2mol��1.6mol��0.8mol��ƽ��ʱ�����ܵ����ʵ���Ϊ6mol��$\frac{4}{5}$=4.8mol����DΪ���壬C��Ϊ���壬���˽��н��
��C��Ϊ���壬��C���ܳ�����ƽ�ⳣ���ı���ʽ�У�
�ڷ�Ӧ��B�����ʵ���Ϊ0.8mol�����˼���B��ƽ��ת����%��
�۷�Ӧ�����������С�����������ϵѹǿ��ƽ�������ƶ���ƽ�ⳣ�����¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣻
��C��Ϊ���壬������C������ƽ�ⲻ�ƶ���
��� �⣺��Ӧһ��ʱ���ﵽƽ�⣬��÷�Ӧǰ��ѹǿ��Ϊ5��4���ʷ�Ӧ�����������С����C��D����һ�ֲ�Ϊ���壻��һ��2L���ܱ������г���A���壬B���壬�����Ũ��Ϊ2mol/L��1mol/L����A���壬B��������ʵ����ֱ�Ϊ2mol/L��2L=4mol��1mol/L��2L=2mol����Ӧǰ�����ܵ����ʵ���Ϊ4mol+2mol=6mol����÷�Ӧǰ��ѹǿ��Ϊ5��4����ƽ��ʱ�����ܵ����ʵ���Ϊ6mol��$\frac{4}{5}$=4.8mol������1.6molC��������D�����ʵ���Ϊ1.6��$\frac{2}{4}$=0.8mol����Ӧ��B�����ʵ���Ϊ1.6��$\frac{2}{4}$=0.8mol����ӦA�����ʵ���Ϊ1.6��$\frac{3}{4}$=1.2mol����ƽ��ʱ��A��B��C��D�����ʵ����ֱ�Ϊ4mol-1.2mol=2.8mol��2mol-0.8mol=1.2mol��1.6mol��0.8mol��ƽ��ʱ�����ܵ����ʵ���Ϊ6mol��$\frac{4}{5}$=4.8mol����DΪ���壬C��Ϊ���壮
��C��Ϊ���壬��C���ܳ�����ƽ�ⳣ���ı���ʽ�У��ʢٴ���
�ڷ�Ӧ��B�����ʵ���Ϊ0.8mol����B��ƽ��ת����Ϊ$\frac{0.8}{2}$��100%=40%���ʢڴ���
�۷�Ӧ�����������С�����������ϵѹǿ��ƽ�������ƶ���ƽ�ⳣ�����¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�ʢ���ȷ��
��C��Ϊ���壬������C������ƽ�ⲻ�ƶ�����A��Bת���ʲ��䣬�ʢ���ȷ��
��˵������ȷ���Ǣۢܣ�
��ѡD��
���� ���⿼�黯ѧƽ�����ؼ��㣬�Ѷ��еȣ��жϳ�C��Ϊ�����ǽ���ĸ��ݣ�

| ʵ����� | ʵ��Ŀ�� | |
| A | ����Ȳʱ�ñ���ʳ��ˮ����ˮ | �ӿ컯ѧ��Ӧ���� |
| B | CH4��SO2�������ͨ��ʢ����ˮ��ϴ��ƿ | ��ȥ��CH4��SO2 |
| C | ������Һˮ�����ȴ�����£�������������ͭ����Һ�۲����� | ��������Ƿ�ˮ�� |
| D | ��Ũ���ᡢ�Ҵ���ϼ����Թ��У����ȣ�Ȼ����ĩ�˲�������KMnO4��Һ�У��۲����� | �����Ƿ�����ϩ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
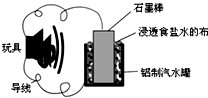 ���������г����IJ��Ͽ��Խ��кܶ��ѧʵ�飬��ͼ����һ���÷Ͼɲ��������Ŀ�����������ߵĵ��ʾ��ͼ������ع���ʱ���й�˵����ȷ���ǣ�������
���������г����IJ��Ͽ��Խ��кܶ��ѧʵ�飬��ͼ����һ���÷Ͼɲ��������Ŀ�����������ߵĵ��ʾ��ͼ������ع���ʱ���й�˵����ȷ���ǣ�������| A�� | ��������ʴ | |
| B�� | �õ�������綯���ʱ��ʯī��Ӧ����ߵ���ĸ������� | |
| C�� | ʯī���Ϸ����ķ�ӦΪ��O2-4e-+2H2O�T4OH- | |
| D�� | �õ�ع���һ��ʱ���ʯī������������� |
| A�� | HX | B�� | H2X | C�� | XH3 | D�� | XH4 |
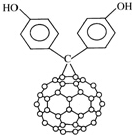 ����C60����̼̼˫����������Ϊ������ϩ����C60�Ķ����ӻ�������ṹ��ͼ�����й���C60�Ķ����ӻ��������������ȷ���ǣ�������
����C60����̼̼˫����������Ϊ������ϩ����C60�Ķ����ӻ�������ṹ��ͼ�����й���C60�Ķ����ӻ��������������ȷ���ǣ�������| A�� | C60�Ķ����ӻ����������ڷ����� | |
| B�� | C60�Ķ����ӻ����������ʽΪC73H12O2 | |
| C�� | C60�Ķ����ӻ���������������������Һ��Ӧ | |
| D�� | 1mol C60�Ķ����ӻ���������������6mol H2�����ӳɷ�Ӧ |
| A�� | ����������Ӧ��Ϊ���� | B�� | ����Ϊ���������һ�� | ||
| C�� | �����Խ�ǿ�Ľ���Ϊ���� | D�� | ������ƫ���Ϊ���� |
| A�� | H2O��H2O2���ַ�����Oԭ�ӵ��ӻ�������ͬ | |
| B�� | NH3��NH4+�������Ŀռ�ṹ��ͬ | |
| C�� | SO42-��ClO4-�������ļ������ | |
| D�� | SO2��O3���ַ����ǵȵ����� |
 A��B��C��D��E��F����Ԫ��Ϊԭ��������������Ķ�����Ԫ�أ�AΪԭ�Ӱ뾶��С��Ԫ�أ�A��B���γ�4ԭ��10���ӵķ���X��C���������������ڲ��3���� Dԭ�ӵ����������������ڲ��������һ�룻E�ǵؿ��к������Ľ���Ԫ�أ�FԪ�ص��������������۴�����Ϊ6����ش��������⣺
A��B��C��D��E��F����Ԫ��Ϊԭ��������������Ķ�����Ԫ�أ�AΪԭ�Ӱ뾶��С��Ԫ�أ�A��B���γ�4ԭ��10���ӵķ���X��C���������������ڲ��3���� Dԭ�ӵ����������������ڲ��������һ�룻E�ǵؿ��к������Ľ���Ԫ�أ�FԪ�ص��������������۴�����Ϊ6����ش��������⣺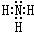 ��D������Һ̬X�з�����������A2C�ķ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ2Na+2NH3=2NaNH2+H2����
��D������Һ̬X�з�����������A2C�ķ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ2Na+2NH3=2NaNH2+H2����