题目内容
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量 氯化钡(或氯化钙) 氯化钡(或氯化钙) 溶液 |
||
| ②过滤,取2mL滤纸于试管中,滴加酚酞 | 溶液变红 |
Na2CO3+CO2+H2O=2NaHCO3,如果无水物中含有 NaHCO3,则一定不含 NaOH,因为二者不共存,那么8.0g NaOH反应得到的无水物至少是10.6g,现在无水物为9.3g,不足10.6g,所以不含NaHCO3,应是NaOH和Na2CO3的混合物,可以用氯化钡(或氯化钙)溶液检验碳酸钠的存在,用无色酚酞检验氢氧化钠的存在,即
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量氯化钡(或氯化钙)溶液 | 产生白色沉淀 | 溶液中含有碳酸钠 |
| ②过滤,取2mL滤纸于试管中,滴加酚酞 | 溶液变红 | 溶液中含有氢氧化钠 |

 (每空1分,共9分)纯碱、烧碱等是重要的化工原料。
(每空1分,共9分)纯碱、烧碱等是重要的化工原料。
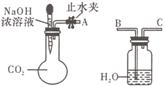
(1)利用如图所示装置可证明二氧化碳与烧碱溶液发生了
反应。将A与B连接,打开止水夹,将胶头滴管中的液体
挤入烧瓶,此时的实验现象是______________________。若其
它操作不变,将A与C连接,可观察到的现象是__________________________________________。
![]() (2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体
(2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体![]() 的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
| 实验操作 | 实验现象 | 结 论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中,滴加酚酞 | 溶液变红 |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
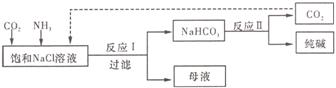
![]() 已知NaHCO3在低温
已知NaHCO3在低温![]() 下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中______循环利用,同时得到融雪剂_____。
②向![]() 母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸碳酸盐转变为溶解度较大的碳酸盐的离子方程式_________________________________。
(每空1分,共9分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可证明二氧化碳与烧碱溶液发生了
反应。将A与B连接,打开止水夹,将胶头滴管中的液体
挤入烧瓶,此时的实验现象是______________________。若其
它操作不变,将A与C连接,可观察到的现象是__________________________________________。 (2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体
(2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体 的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
| 实验操作 | 实验现象 | 结 论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | | |
| ②过滤,取2mL滤液于试管中,滴加酚酞 | 溶液变红 | |

 已知NaHCO3在低温
已知NaHCO3在低温 下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中______循环利用,同时得到融雪剂_____。
②向
 母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸碳酸盐转变为溶解度较大的碳酸盐的离子方程式_________________________________。