题目内容
Cl2与水作用的方程式:
Cl2+H2O=HClO+HCl
Cl2+H2O=HClO+HCl
.氯水是黄绿
黄绿
色,说明氯水中含有的粒子:氯气分子
氯气分子
.分析:氯气与水反应生成盐酸和次氯酸,氯气是黄绿色的气体在水中溶解反应存在化学平衡,所以溶液呈黄绿色,是氯气分子的颜色.
解答:解:氯气与水反应生成盐酸和次氯酸,反应的化学方程式为:Cl2+H2O=HClO+HCl.氯气通入水中发生反应是化学平衡,氯气是黄绿色气体,氯水中含有氯气分子所以呈黄绿;
故答案为:Cl2+H2O=HClO+HC;氯气分子.
故答案为:Cl2+H2O=HClO+HC;氯气分子.
点评:本题考查氯及其化合物的性质.主要考查氯气的性质应用,氯气和水反应的平衡应用,较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 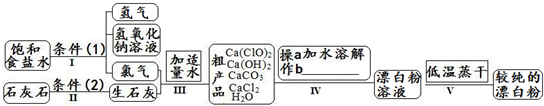 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
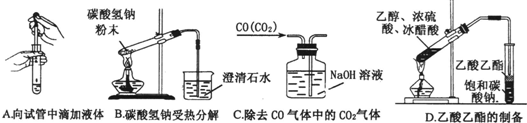
(08潮阳一中模拟)(15分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。 (1)下列实验没有错误的是 。
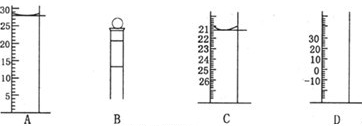
(2)下图为常见仪器的部分结构(有的仪器被放大)
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。 (3)化学研究小组,通过网上查找资料发现,Cl2的制取有下列不同方案:
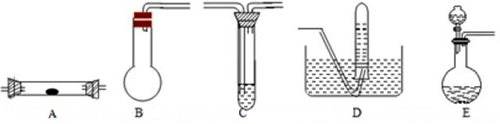
现实验室有供选择的如下几种仪器来制取Cl2
①用上述仪器不能实现的方案为 。不考虑固定装置的仪器,可行但缺仪器的方案是 ,所缺的仪器是 。 若按b方案制Cl2时发生化学方程为_________________, ②若要设计联合实验探究氯气的漂白原理,从制备装置中产生氯气后应连接的装置中所使用的试剂或用品依次是____。 | ||||||||||||||||||||||||||||