题目内容
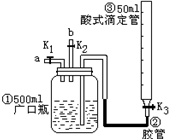 (2009?沈阳一模)某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).
(2009?沈阳一模)某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).I.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作:
打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
.(2)从导管a通入一定量的NO,并测得NO体积为VL(V<50ml,气体体积已经换算为标准状况).准确测得NO体积的主要操作
关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
.II.验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是
气体先变为红棕色然后逐渐变淡
气体先变为红棕色然后逐渐变淡
.写出对应现象的化学方程式2NO+O2=2NO23NO2+H2O=3HNO3+NO
2NO+O2=2NO23NO2+H2O=3HNO3+NO
.(2)继续通入O2,打开K3,并及时调整酸式滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体.
①当通入氧气的体积为
| 1 |
| 2 |
| v |
| 3 |
| v |
| 3 |
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为
| V |
| 11.2 |
| V |
| 11.2 |
分析:I.(1)NO易与氧气反应,通过测量所排出液体的体积从而得到气体体积,广口瓶①中应充满水;
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积;
II.(1)NO易与氧气反应生成红棕色的NO2,NO2又与水反应;
(2)①根据反应方程式4NO+3O2+2H2O═4HNO3过量计算;
②通入的氧气与NO按4NO+3O2+2H2O═4HNO3恰好完全反应,为硝酸溶液,溶液的体积为500ml,求出硝酸的物质的量,利用c=
计算.
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积;
II.(1)NO易与氧气反应生成红棕色的NO2,NO2又与水反应;
(2)①根据反应方程式4NO+3O2+2H2O═4HNO3过量计算;
②通入的氧气与NO按4NO+3O2+2H2O═4HNO3恰好完全反应,为硝酸溶液,溶液的体积为500ml,求出硝酸的物质的量,利用c=
| n |
| V |
解答:解:I (1)通过测量所排出液体的体积从而得到气体体积,广口瓶①中应充满水,操作为:打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
故答案为:打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积.具体操作为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
故答案为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
II.(1)NO易与氧气反应2NO+O2═2NO2 生成红棕色的NO2,NO2又与水反应3NO2+H2O═2HNO3+NO,颜色变浅.
故答案为:气体先变为红棕色然后逐渐变淡;2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;
(2)①令NO的体积为VL,由4NO+3O2+2H2O═4HNO3可知,VLNO 完全反应需 O2
VL,
VL>
VL,所以,氧气不足,NO有剩余,根据氧气计算,由4NO+3O2+2H2O═4HNO3可知,参加反应的NO为
VL×
=
VL,所以剩余的NO未VL-
VL=
VL.
故答案为:
VL
②溶液为硝酸溶液,由4NO+3O2+2H2O═4HNO3可知,n(HNO3)=n(NO)=
=
mol,
所以,c(HNO3)=
=
=
mol/L.
故答案为:
mol/L.
故答案为:打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积.具体操作为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
故答案为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
II.(1)NO易与氧气反应2NO+O2═2NO2 生成红棕色的NO2,NO2又与水反应3NO2+H2O═2HNO3+NO,颜色变浅.
故答案为:气体先变为红棕色然后逐渐变淡;2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;
(2)①令NO的体积为VL,由4NO+3O2+2H2O═4HNO3可知,VLNO 完全反应需 O2
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
故答案为:
| 1 |
| 3 |
②溶液为硝酸溶液,由4NO+3O2+2H2O═4HNO3可知,n(HNO3)=n(NO)=
| VL |
| 22.4L/mol |
| V |
| 22.4 |
所以,c(HNO3)=
| n(HNO3) |
| V |
| ||
| 0.5L |
| V |
| 11.2 |
故答案为:
| V |
| 11.2 |
点评:关键是准确读取液面,为了较准确地测量气体的体积,读数应在保证内外气压相等的条件下,通过调节两端液面,到两端高度相同时再读取体积.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目