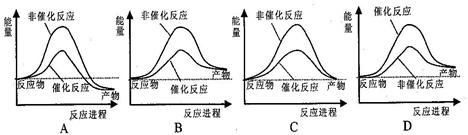
题目内容
已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ 的是
| A.500mL1 mol/LHCl(aq)和500mL 1mol/LNaOH(aq) |
| B.500mL 1mol/LH2SO4(aq)和500mL 1mol/LBa(OH)2(aq) |
| C.1000mL1.0mol/L的CH3COOH(aq)和1000mL1.0mol/L的NaOH(aq) |
| D.1000mL1.0mol/L的HCl(aq)和1000mL1.0mol/L的NaOH(aq) |
D
解析试题分析:中和热的数值是57.3KJ/mol只适用于能用H+ +OH- =H2O的离子方程式表示的强酸强碱稀溶液之间的反应,所以符合的只有D。
考点:本题考查的是中和热的定义。

下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+ O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
Hg(l) + O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ? mol-1 ③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
今有如下三个热化学方程式:
H2(g)+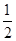 O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol
H2(g)+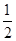 O2(g)=H2O(l);△H=" b" kJ/mol
O2(g)=H2O(l);△H=" b" kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H=" c" kJ/mol
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
下列有关能量转换的说法正确的是( )
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
已知下列热化学方程式:
Zn(s)+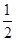 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+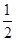 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是 ( )
| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
已知:
(1)Fe2O3(s) +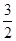 C(s)=
C(s)=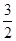 CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+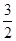 O2(g)=Fe2O3(s) 的ΔH是( )
O2(g)=Fe2O3(s) 的ΔH是( )
| A.-824.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示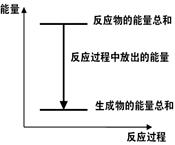 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |